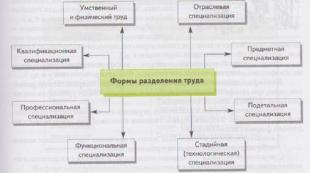
Qurilish materiallarining kimyoviy chidamliligi ularning tarkibi va tuzilishiga qarab. Materiallarning texnologik xususiyatlari. Materiallarning kimyoviy chidamliligi Vladislav Aleksandrovich Lixachev x Asosiy ish kursi
Umumiy va kasb-hunar ta’limi vazirligi
Rossiya Federatsiyasi
MOSKVA DAVLAT Atrof-muhit muhandisligi universiteti
A.G.Parshin V.S.Paxomov D.L.Lebedev
Materiallarning kimyoviy qarshiligi va korroziyadan himoyasi
Laboratoriya ustaxonasi
Doktor Tech tomonidan tahrirlangan. Fanlar A.A.Shevchenko
Moskva - 1998 yil
BBK35.11 q 46
Taqrizchilar:
nomidagi Moskva davlat neft va gaz akademiyasining korroziya kafedrasi. Gubkin;
Ph.D. texnologiya. Fanlar A.S. Abramov, "ShanEco" ekologik kompaniyasi, Moskva.
Moskva davlat atrof-muhit muhandisligi universiteti tahririyat va nashriyot kengashi tomonidan o'quv qo'llanma sifatida tasdiqlangan.
Parshin A.G., Paxomov V.S., Lebedev D.L.
C 46 Materiallarning kimyoviy qarshiligi va korroziyaga qarshi himoya: Laboratoriya ustaxonasi / Ed. A.A.Shevchenko - M.: MSUIE, 1998.-80 b.; kasal.8.
ISBN 5-230-11142-9
Seminarda elektrokimyoviy korroziya va metallarni himoya qilish bo'yicha to'rtta laboratoriya ishlari mavjud: "Vodorod ionlarining qaytarilishida metallarning korroziyasiga strukturaviy heterojenlik ta'siri", "Metallarning kislorod depolarizatsiyasi bilan korroziyasi", "Elektrod potentsiali", "Kontaktli korroziya. va metallarni korroziyadan katodik himoya qilish. Metalllarning elektrokimyoviy korroziyasi nazariyasining asosiy tushunchalari va korroziya tadqiqotlarini o'tkazish metodologiyasi bayon etilgan. Materiallarning kimyoviy chidamliligi va korroziyaga qarshi himoya kursini o'rganuvchi kunduzgi bo'lim 3 va 4-kurs talabalari uchun mo'ljallangan.
ISBN 5-230-11142-9 UDC620.193 BBK 35.11
© A.G.Parshin, V.S.Paxomov, D.L.Lebedev.1998
© MSUIE, 1998
Muqaddima
Laboratoriya mashg'ulotlari bir qator mutaxassisliklar o'quv rejasida nazarda tutilgan "Materiallarning kimyoviy chidamliligi va korroziyaga qarshi himoya" kurs dasturiga muvofiq tuzilgan. Seminarda kompozit materiallar va korroziyadan himoya qilish kafedrasida ishlab chiqilgan metallarning elektrokimyoviy korroziyasi bo'yicha ishlar kiritilgan.
Har bir laboratoriya ishi nazariy qismdan boshlanadi. Vodorod ionlarining katodli qaytarilishi, kislorodning depolarizatsiyasi, metall-elektrolitlar chegarasida muvozanat va nomutanosiblik jarayonlarida korroziyaning mexanizmi, termodinamikasi va kinetikasi, elektrod potensiallari nazariyasi ko'rib chiqiladi.
Nazariy masalalarni taqdim etishda korroziya jarayonlarining mexanizmi va kinetikasi haqidagi zamonaviy elektrokimyoviy tushunchalardan foydalaniladi.
Laboratoriya ishlarini bajarish talabalarga metallarni korroziya va himoya qilishni o'rganish asoslarini yaxshiroq tushunishga imkon beradi, shuningdek, asosiy laboratoriya korroziya-elektrokimyoviy tadqiqotlarni o'tkazish ko'nikmalarini o'rgatadi.
Laboratoriya jurnalini yuritish
1) ishning nomi va maqsadi;
2) o'rnatish sxemasi;
3) tajribalar natijalari va ularni qayta ishlash jadvali (hisob-kitoblar, grafiklar);
4) xulosalar.
Jurnal toza va darhol toza saqlanishi kerak, ya'ni. barcha tadqiqot va sinov faoliyati yozuvlari bilan bir xil tarzda saqlanadi.
O'rnatish sxemasi og'zaki tushuntirishlarsiz aniq va tushunarli bo'lishi kerak.
Tajriba sharoitlarini ta'minlash kerak: sinovdan o'tgan materiallar, namunalarning sirt maydoni, elektrolitlar tarkibi va kontsentratsiyasi, harorat va boshqalar.
Sinov natijalari oldindan tuzilgan jadvallarga yozilishi kerak, ularning shakllari ish tavsifida keltirilgan.
Har xil miqdorlarni yozishda ularning o'lchamlarini ko'rsatish kerak. O'lchov natijalari, qoida tariqasida, qo'shimcha ishlov berish - analitik va grafik (korroziyaning massa, hajm va chuqurlik ko'rsatkichlarini hisoblash, potentsiallar va boshqalar). Bunday hollarda hisoblash formulasini va bitta hisobni to'liq taqdim etish kerak, ya'ni. Eksperimental qiymatlarni formulaga almashtirish bilan va boshqa shunga o'xshash hisob-kitoblar uchun - faqat yakuniy natijalar.
Olingan va shunga muvofiq qayta ishlangan natijalarga asoslanib, bajarilgan ishlar haqida qisqacha xulosalar chiqarish kerak. Tugatgandan so'ng, eksperimental ma'lumotlar bilan jurnalni viza uchun o'qituvchiga topshiring.
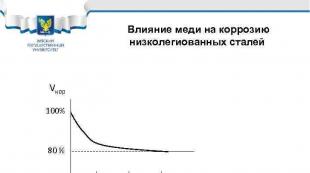
 Misning past qotishma po'latlarning korroziyasiga ta'siri Vcor 100% 80% 0. 1 0. 2 0. 3% Cu Po'latlarga misollar: 10 HSND, 10 G 2 S 1 D, 10 KhDNP, 09 G 2 D, 18 G 2 AF(D)
Misning past qotishma po'latlarning korroziyasiga ta'siri Vcor 100% 80% 0. 1 0. 2 0. 3% Cu Po'latlarga misollar: 10 HSND, 10 G 2 S 1 D, 10 KhDNP, 09 G 2 D, 18 G 2 AF(D)
 Korroziyaga chidamli po'latlarning tasnifi 1. Korroziyaga chidamli (zanglamaydigan) po'latlar va qotishmalar elektrolitlardagi elektrokimyoviy korroziyaga qarshilik ko'rsatadigan materiallardir. 2. Korroziyaga chidamli qotishmaning asosiy qotishma elementi xromdir. 3. Xrom zanglamaydigan po'latlarga Tamman qoidasiga muvofiq kiritiladi. 4. Ushbu po'latlar ishlatiladigan muhitga qarab, korroziyaga chidamli (zanglamaydigan) po'lat va qotishmalarning beshta guruhi ajratiladi.
Korroziyaga chidamli po'latlarning tasnifi 1. Korroziyaga chidamli (zanglamaydigan) po'latlar va qotishmalar elektrolitlardagi elektrokimyoviy korroziyaga qarshilik ko'rsatadigan materiallardir. 2. Korroziyaga chidamli qotishmaning asosiy qotishma elementi xromdir. 3. Xrom zanglamaydigan po'latlarga Tamman qoidasiga muvofiq kiritiladi. 4. Ushbu po'latlar ishlatiladigan muhitga qarab, korroziyaga chidamli (zanglamaydigan) po'lat va qotishmalarning beshta guruhi ajratiladi.
 Engil agressiv muhitlar uchun korroziyaga chidamli po'latlar Birinchi guruhning po'latlari faqat yopiq atmosferada va majburiy davriy quritish bilan suv osti korroziyasida ishlashi mumkin. Ochiq atmosfera va doimiy suv osti korroziyasi (ayniqsa, issiq suvda), shuningdek, er osti korroziyasi sharoitida bu po'latlar chuqur korroziyaga uchraydi. Bu po'latlarga xromli po'latlar kiradi: 08 X 13, 09 X 13, 08 X 17 G (ferrit), 10 X 13, 12 X 13 (martensitik-ferrit), 20 X 13, 30 X 13, 40 X 13 (martensitik) . Shuningdek, nikelni tejamkor qotishmali xrom-marganets va xrom-nikel po'latlari (2 -4%) 15 X 17 AG 14, 10 X 14 AG 15, 10 X 14 G 14 N 3 T, 12 X 17 G 14 N 3 , 08 X 18 G 8 N 2 T
Engil agressiv muhitlar uchun korroziyaga chidamli po'latlar Birinchi guruhning po'latlari faqat yopiq atmosferada va majburiy davriy quritish bilan suv osti korroziyasida ishlashi mumkin. Ochiq atmosfera va doimiy suv osti korroziyasi (ayniqsa, issiq suvda), shuningdek, er osti korroziyasi sharoitida bu po'latlar chuqur korroziyaga uchraydi. Bu po'latlarga xromli po'latlar kiradi: 08 X 13, 09 X 13, 08 X 17 G (ferrit), 10 X 13, 12 X 13 (martensitik-ferrit), 20 X 13, 30 X 13, 40 X 13 (martensitik) . Shuningdek, nikelni tejamkor qotishmali xrom-marganets va xrom-nikel po'latlari (2 -4%) 15 X 17 AG 14, 10 X 14 AG 15, 10 X 14 G 14 N 3 T, 12 X 17 G 14 N 3 , 08 X 18 G 8 N 2 T
 Sho'rlangan muhit uchun korroziyaga chidamli (zanglamaydigan) po'latlar Ikkinchi guruh korroziyaga chidamli (zanglamaydigan) po'latlar sho'rlangan muhitda past haroratlarda, xususan, dengiz korroziyasida qo'llaniladi. Korroziyaga chidamliligini oshirish Ni po'latlarini (5 - 8%) qo'shimcha iqtisodiy qotishma orqali erishiladi. Misollar: 09 X 15 N 8 Yu, 07 X 16 N 6, 08 X 17 N 5 M 3 (po'lat sulfat kislotali muhitda ishlatiladi), 09 X 17 N 7 Yu 1 (po'latlar dengiz korroziyasi sharoitida ishlatiladi).
Sho'rlangan muhit uchun korroziyaga chidamli (zanglamaydigan) po'latlar Ikkinchi guruh korroziyaga chidamli (zanglamaydigan) po'latlar sho'rlangan muhitda past haroratlarda, xususan, dengiz korroziyasida qo'llaniladi. Korroziyaga chidamliligini oshirish Ni po'latlarini (5 - 8%) qo'shimcha iqtisodiy qotishma orqali erishiladi. Misollar: 09 X 15 N 8 Yu, 07 X 16 N 6, 08 X 17 N 5 M 3 (po'lat sulfat kislotali muhitda ishlatiladi), 09 X 17 N 7 Yu 1 (po'latlar dengiz korroziyasi sharoitida ishlatiladi).
 O'rtacha korroziyali muhitda foydalanish uchun po'latlar turli haroratlarda tuzlarning eritmalarini, shuningdek, ba'zi kislotalarning zaif eritmalarini anglatadi. Uchinchi guruhning po'latlari keng qo'llaniladigan eng keng tarqalgan zanglamaydigan po'latdir. Ushbu po'latlar orasida biz quyidagilarni ajratib ko'rsatishimiz mumkin: a) po'latlar - yuqori nikelli po'latlarning o'rnini bosuvchi moddalar: 15 X 25 T, 15 X 28, 08 X 22 N 6 T, 12 X 21 N 5 T. b) nikelga optimal xromli po'latlar. nisbati (Cr: Ni = 18: 9, 18: 10): 12 X 18 N 9 T va 12 X 18 N 10 T, 17 X 18 N 9, 12 X 18 N 10 B, 08 X 18 N 10, 12 X 18 N 12 T, 08 X 18 N 12 B, 06 X 18 N 11 va boshqalar.
O'rtacha korroziyali muhitda foydalanish uchun po'latlar turli haroratlarda tuzlarning eritmalarini, shuningdek, ba'zi kislotalarning zaif eritmalarini anglatadi. Uchinchi guruhning po'latlari keng qo'llaniladigan eng keng tarqalgan zanglamaydigan po'latdir. Ushbu po'latlar orasida biz quyidagilarni ajratib ko'rsatishimiz mumkin: a) po'latlar - yuqori nikelli po'latlarning o'rnini bosuvchi moddalar: 15 X 25 T, 15 X 28, 08 X 22 N 6 T, 12 X 21 N 5 T. b) nikelga optimal xromli po'latlar. nisbati (Cr: Ni = 18: 9, 18: 10): 12 X 18 N 9 T va 12 X 18 N 10 T, 17 X 18 N 9, 12 X 18 N 10 B, 08 X 18 N 10, 12 X 18 N 12 T, 08 X 18 N 12 B, 06 X 18 N 11 va boshqalar.
 Korrozivligi yuqori bo'lgan muhitda foydalanish uchun po'latlar Ushbu turdagi po'latlar issiq Na eritmalarida kimyoviy qarshilikni oshirish uchun ishlab chiqilgan. Cl va kislota eritmalarida. Po'latlarning qarshiligini oshirish uchun molibden va mis bilan qo'shimcha qotishma qo'llaniladi va bu guruhning po'latlarida ular ko'pincha texnologik jihatdan qulay bo'lgan ostenitik strukturani saqlab qolishga intiladi, bu esa po'latlarni nikel bilan qo'shimcha qotishmasini talab qiladi. Ushbu guruhning po'latlari, birinchi navbatda nikel, qotishma tarkibiy qismlarining yuqori miqdori tufayli juda qimmat. Guruhdagi po'latlarga misollar: 10 X 17 N 13 M 2 T 08 X 17 N 13 M 3 T, 08 X 17 N 15 M 3 T, 04 X 28 MDT, 03 X 28 MDT, 06 X 28 MT.
Korrozivligi yuqori bo'lgan muhitda foydalanish uchun po'latlar Ushbu turdagi po'latlar issiq Na eritmalarida kimyoviy qarshilikni oshirish uchun ishlab chiqilgan. Cl va kislota eritmalarida. Po'latlarning qarshiligini oshirish uchun molibden va mis bilan qo'shimcha qotishma qo'llaniladi va bu guruhning po'latlarida ular ko'pincha texnologik jihatdan qulay bo'lgan ostenitik strukturani saqlab qolishga intiladi, bu esa po'latlarni nikel bilan qo'shimcha qotishmasini talab qiladi. Ushbu guruhning po'latlari, birinchi navbatda nikel, qotishma tarkibiy qismlarining yuqori miqdori tufayli juda qimmat. Guruhdagi po'latlarga misollar: 10 X 17 N 13 M 2 T 08 X 17 N 13 M 3 T, 08 X 17 N 15 M 3 T, 04 X 28 MDT, 03 X 28 MDT, 06 X 28 MT.
 Juda agressiv muhitlar uchun nikel asosidagi qotishmalar Juda yuqori agressivlikka ega bo'lgan muhitlar sulfat va xlorid kislotalarning issiq eritmalari deb tushuniladi. Bunday agressiv muhitda eng chidamli metall materiallar nikel asosidagi qotishmalardir. Masalan, KhN 65 MV qotishmasi sulfat va xlorid kislotasi muhitida, konsentrlangan sirka kislotasida yuqori haroratlarda barqaror. Qotishma N 70 MF sulfat va xlorid kislota eritmalarida foydalanish uchun tavsiya etiladi qotishma intergranular korroziyaga nisbatan ancha chidamli;
Juda agressiv muhitlar uchun nikel asosidagi qotishmalar Juda yuqori agressivlikka ega bo'lgan muhitlar sulfat va xlorid kislotalarning issiq eritmalari deb tushuniladi. Bunday agressiv muhitda eng chidamli metall materiallar nikel asosidagi qotishmalardir. Masalan, KhN 65 MV qotishmasi sulfat va xlorid kislotasi muhitida, konsentrlangan sirka kislotasida yuqori haroratlarda barqaror. Qotishma N 70 MF sulfat va xlorid kislota eritmalarida foydalanish uchun tavsiya etiladi qotishma intergranular korroziyaga nisbatan ancha chidamli;
 Betonning zichligini oshirish 4. Polimer qo'shimchalarini kiritish 4. 1. beton aralashmasiga oz miqdorda 0,2 - 3% polimer qo'shimchalarini kiritish (latekslar, polimer smolalari); 4. 2. polimer biriktiruvchi (polimer eritmalari va polimer beton) asosida beton ishlab chiqarish; Konservalarda quruq aralash va qattiqlashtiruvchi sifatida yetkazib beriladi. 4. 3. tayyor beton va temir-beton buyumlarni polimer birikmalari yoki monomerlar bilan keyinchalik ularni to'g'ridan-to'g'ri beton korpusda (beton polimerlar) polimerizatsiya qilish bilan singdirish; 4. 4. betonni polimer tolalar bilan mustahkamlash (tolali temir-beton ishlab chiqarish)
Betonning zichligini oshirish 4. Polimer qo'shimchalarini kiritish 4. 1. beton aralashmasiga oz miqdorda 0,2 - 3% polimer qo'shimchalarini kiritish (latekslar, polimer smolalari); 4. 2. polimer biriktiruvchi (polimer eritmalari va polimer beton) asosida beton ishlab chiqarish; Konservalarda quruq aralash va qattiqlashtiruvchi sifatida yetkazib beriladi. 4. 3. tayyor beton va temir-beton buyumlarni polimer birikmalari yoki monomerlar bilan keyinchalik ularni to'g'ridan-to'g'ri beton korpusda (beton polimerlar) polimerizatsiya qilish bilan singdirish; 4. 4. betonni polimer tolalar bilan mustahkamlash (tolali temir-beton ishlab chiqarish)

 Modul 7. Metalllarni elektrokimyoviy korroziyadan himoya qilish usullari. Ma’ruza 7. 3 METALLARNI KOROZIYONDAN ELEKTROKIMYOVIY HIMOYA QILISh Katodik himoya korroziyaga uchragan konstruksiya metallining potensialini tok manbaining manfiy qutbiga tutashtirib manfiy tomonga siljitishdan iborat.
Modul 7. Metalllarni elektrokimyoviy korroziyadan himoya qilish usullari. Ma’ruza 7. 3 METALLARNI KOROZIYONDAN ELEKTROKIMYOVIY HIMOYA QILISh Katodik himoya korroziyaga uchragan konstruksiya metallining potensialini tok manbaining manfiy qutbiga tutashtirib manfiy tomonga siljitishdan iborat.
 Modul 7. Metalllarni elektrokimyoviy korroziyadan himoya qilish usullari. Ma'ruza 7. 3 Katodik himoyaning korroziya diagrammasi
Modul 7. Metalllarni elektrokimyoviy korroziyadan himoya qilish usullari. Ma'ruza 7. 3 Katodik himoyaning korroziya diagrammasi
 Modul 7. Metalllarni elektrokimyoviy korroziyadan himoya qilish usullari. Ma'ruza 7. 2 Himoya muhofazasi aloqada bo'lgan ikkita metalning korroziya xususiyatlariga asoslanadi. Kontaktli korroziya nazariyasiga ko'ra, musbat metall M 2 ko'proq manfiy metall M 1 bilan aloqa qilganda, M 2 metallning potentsiali manfiy tomonga siljiydi va uning korroziyasi kamayadi yoki butunlay to'xtaydi.
Modul 7. Metalllarni elektrokimyoviy korroziyadan himoya qilish usullari. Ma'ruza 7. 2 Himoya muhofazasi aloqada bo'lgan ikkita metalning korroziya xususiyatlariga asoslanadi. Kontaktli korroziya nazariyasiga ko'ra, musbat metall M 2 ko'proq manfiy metall M 1 bilan aloqa qilganda, M 2 metallning potentsiali manfiy tomonga siljiydi va uning korroziyasi kamayadi yoki butunlay to'xtaydi.
 Modul 7. Metalllarni elektrokimyoviy korroziyadan himoya qilish usullari. Ma'ruza 7. 3 Anodik himoya faqat korroziy muhitda passivlanishga moyil bo'lgan metallar uchun qo'llaniladi. Bu tashqi oqim manbai yordamida metall potentsialini faol eritma hududidan passivatsiya hududiga o'tkazishga to'g'ri keladi.
Modul 7. Metalllarni elektrokimyoviy korroziyadan himoya qilish usullari. Ma'ruza 7. 3 Anodik himoya faqat korroziy muhitda passivlanishga moyil bo'lgan metallar uchun qo'llaniladi. Bu tashqi oqim manbai yordamida metall potentsialini faol eritma hududidan passivatsiya hududiga o'tkazishga to'g'ri keladi.
 Modul 7. Metalllarni elektrokimyoviy korroziyadan himoya qilish usullari. Ma'ruza 7. 3 Anodik himoyaning korroziya diagrammasi
Modul 7. Metalllarni elektrokimyoviy korroziyadan himoya qilish usullari. Ma'ruza 7. 3 Anodik himoyaning korroziya diagrammasi
ROSSIYA FEDERATSIYASI TA'LIM VA FAN VAZIRLIGI FEDERAL DAVLAT TA'LIM MASSASİYASI "SANKT-PETERBURG DAVLAT TEXNOLOGIYA UNIVERSITETI POLIMERLARI" M.I.I.I.I.I.Ilovina T.L MATERIALLAR TANSI VA KOROZİYONDAN HIMOYA QILISh Darslik Sankt-Peterburg 2014 1 UDC 546(075) BBK 24.1ya7 L 840 Lukanina T. L., Mixaylova I. S., Radin M. A. Materiallarning kimyoviy qarshiligi va korroziyaga qarshi himoya: darslik. qo'llanma - Sankt-Peterburg: SPbGTURP, 2014. - 85 p. Qo'llanmada kimyoviy korroziyaning termodinamiği va kinetikasi, mexanizmlari va elektrokimyoviy korroziyaning har xil turlari, kimyo sanoati uskunalariga xos bo'lgan muhit va sharoitlarni hisobga olgan holda zamonaviy g'oyalar berilgan. Korroziyaga chidamli po'lat va qotishmalarni yaratishning ilmiy tamoyillari va konstruktiv materiallarni korroziyadan himoya qilish usullari ko'rsatilgan. O‘quv qo‘llanma texnik oliy o‘quv yurtlari va texnologik mutaxassisliklar bo‘yicha tahsil olayotgan fakultet talabalari uchun mo‘ljallangan. Aspirantlar, kimyo korxonalarining ilmiy va muhandislik xodimlari, metallarni korroziyadan himoya qilish bilan shug'ullanadigan loyiha va tadqiqot tashkilotlari uchun foydali bo'lishi mumkin. Taqrizchilar: Doktor Chem. fanlari, prof. Sankt-Peterburg davlat ITMO kimyo kafedrasi. fakultet Slobodov A. A.; Ph.D. kimyo. fanlari, dotsent Turkmaniston Sankt-Peterburg Davlat Texnika Universitetining Organik kimyo kafedrasi, Evdokimov A.N. Universitet tahririyat-nashriyot kengashi tomonidan o‘quv qo‘llanma sifatida nashrga tavsiya etilgan. Muharrir va korrektor T. A. Smirnova Tech. Muharrir L.Ya Titova Templan 2014, pos. 45 ________________________________________________________________ 14.04.14 nashrga taqdim etilgan Format 60×84/16. №1 qog'oz turi. Ofset bosib chiqarish. Chop etilgan l.5.5. Uch.-nashr varaqlari 5.5 tiraj 45-sonli nashr. Ivana Chernyx, 4 Sankt-Peterburg davlat o'simlik polimerlari texnologik universiteti, 2014 Lukanina T. L., Mixaylova I. S., Radin M. A., 2014 2 KIRISh Materiallarning korroziyasi atrof-muhit bilan kimyoviy yoki elektrokimyoviy o'zaro ta'sir natijasida o'z-o'zidan yo'q bo'lib ketishi. Metall va qotishmalarning korroziya natijasida nobud bo'lishi, tana yoki atrof-muhit bilan mexanik o'zaro ta'sir natijasida yuzaga keladigan eroziya yoki eskirish kabi o'z-o'zidan yo'q qilishning boshqa turlaridan farq qiladi. Aksariyat metallar va qotishmalar uchun ish sharoitida oksidlangan (ionli) holat yanada barqaror bo'lib, ular korroziya natijasida o'tadi. "Korroziya" atamasi lotincha "corrodere" so'zidan kelib chiqqan bo'lib, "korroziya" degan ma'noni anglatadi. Korroziyadan yo'qotishlar odatda to'g'ridan-to'g'ri va bilvosita bo'linadi. To'g'ridan-to'g'ri yo'qotishlarga quyidagilar kiradi: − korroziya mahsulotiga aylanadigan metall tannarxi, shuningdek, texnik shartlarda nazarda tutilgan amortizatsiya muddati tugagunga qadar ishdan chiqqan korroziyaga uchragan asbob-uskunalar qiymati. Bundan tashqari, qoida tariqasida, asbob-uskunalarni ishlab chiqarish narxi u ishlab chiqarilgan metallning narxidan ancha yuqori; - korroziya uchun ruxsatnomalarning ko'payishi, bu nafaqat metall iste'molining oshishiga, balki dizaynning yomonlashishiga ham olib keladi. Masalan, bir xil tashqi diametrli quvur liniyasi uchun metallning ko'payishi foydali kesimning pasayishiga va natijada trubaning o'tkazuvchanligini pasayishiga olib keladi; − metall va metall bo‘lmagan qoplamalar, korroziyaga chidamli materiallar, ingibitorlar va h.k. ko‘rinishidagi himoya choralari uchun xarajatlar. Korroziyadan bilvosita yo‘qotishlar quyidagi sabablarga ko‘ra yuzaga keladi: − ishlamay qolgan uskunani rejadan tashqari ta’mirlash uchun qo‘shimcha xarajatlar; − korroziyadan shikastlangan asbob-uskunalarni ta’mirlashda to‘xtashlar natijasida kam ishlab chiqarish; - baxtsiz hodisalar, portlashlar va yong'inlar ehtimoli; − korroziya natijasida asbob-uskunalar devorlarida teshiklar paydo bo'lishi sababli mahsulotlarning oqishi; 3 - suyuqlik oqimining zarur quvvatini ushlab turish uchun qo'shimcha energiya sarfini talab qiladigan korroziya mahsulotlarini cho'ktirish natijasida quvurlarning kesishishini qisqartirish; − korroziya mahsulotlari bilan ifloslanish natijasida mahsulot sifatining pasayishi. Korroziya va metallarni himoya qilish fani metallar va qotishmalarning korroziy muhit bilan o'zaro ta'sirini o'rganadi, bu o'zaro ta'sir mexanizmini va uning umumiy tamoyillarini o'rnatadi. Metalllarning korroziyasi va himoyasini o'rganishning ilmiy asosini metallshunoslik va fizik kimyo tashkil etadi. Ushbu fanning yakuniy amaliy maqsadi metallarni qayta ishlash va asbob-uskunalarni ishlatish jarayonida ularni korroziy yo'q qilishdan himoya qilishdir. 1-bob. KOROZIYON HAQIDA UMUMIY MA'LUMOT 1.1. Korroziya jarayonlarining termodinamiği va kinetikasi Korroziyaning birlamchi sababi ma'lum tashqi sharoitlarda metallarning turli muhitdagi termodinamik beqarorligidir. Korroziya jarayonining o'z-o'zidan paydo bo'lishining asosiy imkoniyati termodinamika qonunlari bilan belgilanadi. Har qanday spontan jarayonning paydo bo'lishi erkin energiyaning kamayishi bilan birga keladi. Korroziya jarayonlarining o'z-o'zidan paydo bo'lish imkoniyatini izobarik-izotermik potentsial DG1 o'zgarishi bilan baholash mumkin. Metallning o'z-o'zidan oksidlanish jarayoni - korroziya, agar ∆G bo'lsa, mumkin< 0, то есть знак ―минус‖ означает, что изобарно−изотермический потенциал убывает и свободная энергия системы уменьшается. Наоборот, если ∆G > 0 bo'lsa, izobarik-izotermik potentsialning ortiqcha belgisi erkin energiyaning ko'payishiga to'g'ri keladi, bu esa bu reaktsiyaning o'z-o'zidan paydo bo'lishining mumkin emasligini ko'rsatadi. IZOBARIK-IZOTERMAL POTENTSIAL (DAG) – Gibbs energiyasi, termodinamik potentsiallardan biri, DG = DAN - TDS ga teng, bu erda DN, DS, T - sistemaning entalpiyasi, entropiyasi, termodinamik harorati. DG tizimdagi zarrachalar soniga proportsionaldir. Bir zarracha deb ataladi, u kimyoviy potentsial deb ataladi. DG materiya va uning atrofidagi jismlar o'rtasida almashinish mumkin bo'lgan jarayonlarni tavsiflash uchun qulaydir. Doimiy bosimda sodir bo'ladigan izotermik muvozanat jarayonida bu tizimning umumiy ishi minus tashqi bosim kuchlariga qarshi ishdir. Bu izobarik-izotermik potentsialning pasayishiga teng (ya'ni, maksimal foydali ish). 1 4 Biroq, termodinamika o'rganilayotgan tizimning muvozanat holatidan qanchalik uzoqda ekanligini va o'z-o'zidan reaktsiyaga qodirligini aniqlash imkonini bersa-da, bu jarayonning tezligini bildirmaydi. Korroziya tezligi uning kinetikasi bilan belgilanadi. Korroziya jarayonlarining xususiyati ularning heterojenligidir. Buning sababi shundaki, metallni yo'q qilish har xil agregatsiya holatiga ega bo'lgan ikki faza orasidagi interfeysda, masalan, metall-suyuqlik, metall-gaz interfeysida sodir bo'ladi. Bunday sharoitda kimyoviy o'zaro ta'sirning kinetikasining hal qiluvchi omili kimyoviy o'zaro ta'sir tezligi yoki reagentlarning kontakt fazalari hajmlaridan korroziya o'zaro ta'siri sodir bo'ladigan interfeysga etkazib berish va aksincha reaktsiya mahsulotlarini olib tashlashdir. yo'nalishi. Birinchi holda, korroziya tezligi kinetik nazorat bilan, ikkinchisida - diffuziya nazorati bilan aniqlanadi. Ba'zi hollarda korroziya tezligi aralash diffuziya-kinetik nazorat bilan aniqlanadi. Stabil holatdagi jarayon uchun kimyoviy reaksiya tezligi va diffuziya tezligi teng. Korroziya jarayoni bir necha bosqichlardan iborat bo'lib, ular ketma-ket yoki parallel ravishda sodir bo'lishi mumkin. Bir necha ketma-ket bosqichlardan iborat korroziya jarayonining barqaror holatdagi umumiy tezligi eng sekin bosqich tezligi bilan belgilanadi. Jarayonning alohida bosqichlari parallel ravishda sodir bo'lganda, umumiy korroziya tezligi eng tez bosqich bilan belgilanadi. Shuning uchun, agar bosqichlardan biri boshqasiga qaraganda tezroq davom etsa, ikkinchi bosqichni e'tiborsiz qoldirish mumkin. 1.2. Korroziya jarayonlarining paydo bo'lish mexanizmi bo'yicha tasnifi Korroziya jarayonlarining paydo bo'lishi uchun sharoitlarning juda xilma-xilligidan qat'i nazar, ularni ikkita asosiy xususiyatga ko'ra tasniflash mumkin: - jarayon mexanizmiga ko'ra - korroziyani yo'q qilish xususiyatiga ko'ra. . KIMYOVIY va ELEKTROKIMYOVIY korroziya mavjud. 5 quruq gazlarda (gaz korroziyasi) va suyuq noelektrolitlarda2 (elektrolitlar bo'lmagan korroziya) uchraydi. Agar muhit elektrolit bo'lmasa (quruq gazlar yoki suyuq bo'lmagan elektrolitlar), u holda elektron almashinuvi to'g'ridan-to'g'ri qaytaruvchi metall (qizil) va elektronlarni o'ziga jalb qila oladigan elektron manfiy elementni o'z ichiga olgan har qanday modda - oksidlovchi vosita (ho'kiz) o'rtasida sodir bo'ladi. ), masalan: Fe + Sl2 → FeCl2 (1) KIMYOVIY KOROZIYON qizil Elektron oʻtkazuvchanligi balansi Feº − 2ē → Fe2+ 1 Sl2º + 2ē → 2Cl− Feº + 2Slº = Fe2AL + 2Cl− ELEKTOROXEM a jarayonining oʻzaro taʼsiri. korroziy muhitga ega bo'lgan metall (elektrolitlar eritmasi), bunda metall atomlarining ionlanishi va korroziy muhitning oksidlovchi komponentining kamayishi bir harakatda sodir bo'lmaydi va ularning tezligi elektrod potentsialiga bog'liq. Elektrokimyoviy korroziya jarayonining o'ziga xos xususiyatlari quyidagilardan iborat: – ikkita alohida jarayonning bir vaqtning o'zida sodir bo'lishi - oksidlanish (metallning erishi) va qaytarilish (vodorodning ajralishi, kislorodning qaytarilishi, eritmadan metallning ajralib chiqishi va boshqalar); - metallning erishi jarayoni metalldagi elektronlar va elektrolitlardagi ionlarning yo'nalishli harakati bilan birga keladi, ya'ni. elektr tokining paydo bo'lishi; - korroziya mahsulotlari ikkilamchi reaktsiyalar natijasida hosil bo'ladi. Elektrokimyoviy korroziyada sodir bo'ladigan oksidlanish-qaytarilish jarayonlarini quyidagi reaksiyalar shaklida ko'rsatish mumkin: Me − nē→ Men+ (anodik jarayon) (2) n− R(ox) + nē → R (qizil) (katod jarayoni), (3 ) bu yerda R(ox) oksidlovchi moddadir; NOELEKTROLITLAR - suvli eritmalari va eritmalari elektr tokini o'tkazmaydigan moddalardir. Ular ionlarga parchalanmaydigan kovalent qutbsiz yoki past qutbli aloqalarni o'z ichiga oladi. Gazlar, qattiq moddalar (metall bo'lmaganlar) va organik birikmalar (saxaroza, benzin, spirt) elektr tokini o'tkazmaydi. 2 6 R n−(qizil) – oksidlovchi moddaning qaytarilgan shakli; nē - uzatilgan elektronlar soni. Elektrokimyoviy korroziyaga misol sifatida temirning suv ta'sirida oksidlanish (zanglash) jarayonini ko'rsatish mumkin: Fe - 2ē → Fe2+ (anodik jarayon - temirning erishi) H2O + ½O2 +2ē → 2OH– (katod jarayoni - kislorodning qaytarilishi) −————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————— — − Fe 2+ + 2OH – → Fe(OH)2 (korroziya mahsulotlari hosil bo‘lishi) (2) va (3) reaksiyalar konjugat holda boradi, lekin o‘z kinetik qonunlariga bo‘ysunadi. Bunday holda, jarayonning statsionarlik shartlariga rioya qilish kerak, ya'ni. metall oksidlanish va oksidlovchi moddaning qaytarilish tezligining tengligi. Bu reaksiyalar geografik jihatdan ajratilishi va sirtning turli qismlarida sodir bo'lishi mumkin. Statsionarlik shartlaridan kelib chiqadiki, butun jarayon tezligi pasayishi uchun konjugat reaktsiyalaridan birini sekinlashtirish kifoya. 1.3. Korroziya jarayonlarining korroziyaga uchraganligi tabiatiga ko'ra tasnifi Metallning korroziya bilan yo'q bo'lish xususiyatiga ko'ra, UMUMIY VA MAHALLIY KOROZIYON ajraladi. UMUMIY KOROZIYON metallning butun yuzasiga tarqaladi; u bir xil yoki notekis bo'lishi mumkin (1. - 1.2-rasm). 1 2 4 5 7 8 3 6 9-rasm. 1. Korroziya shikastlanishining turlari Korroziyaning ko'p holatlariga umumiy korroziya kiradi, masalan, metallning elektrolitlar ta'siriga tushishi natijasida korroziya mahsulotlari metall yuzasida qolmaydi. Shunday qilib, misning nitrat kislotasi, 7 temirning xlorid kislotasi bilan, alyuminiyning oʻyuvchi ishqorlar bilan, ruxning sulfat kislota bilan va boshqalar bilan oʻzaro taʼsirida kuchli umumiy korroziya kuzatiladi.. Yagona umumiy korroziya korroziyaning eng xavfli turlaridan biri hisoblanadi. korroziya shikastlanishi natijasida metallning erishi tezligi apparat, qurilma va boshqalarning ishlashi uchun talablar bilan belgilangan standartlardan oshmaydi. Agar metall etarlicha qalin bo'lsa, korroziya strukturaning mexanik kuchini kesishma bo'ylab bir xil taqsimlangan stresslar (kuchlanish, siqish) ostida kam ta'sir qiladi. Biroq, umumiy korroziya qismlar egilishga va buralishga duchor bo'lganda xavfli bo'lishi mumkin, chunki bu holda eng yuklangan qatlamlar yo'q qilinadi. MALAKAL KOROZIYON - metall yuzaning faqat ba'zi joylarini yo'q qilishga olib keladi, qolganlari esa vayron bo'lmaydi yoki yo'q qilish tezligi juda past. Mahalliy korroziyaning ko'rinishlari juda xilma-xil bo'lib, turli darajadagi notekisliklarga ega bo'lishi mumkin va shuning uchun mahalliy korroziya BO'LGAN KOROZIYON, YARALAR, POTS (CHUKURLAR), SELANLASH KOROZIYON, KOROZIYON, KOROZİV YORISH BO'LADI. INTERKRISTALLIT Dog'lar, yaralar, nuqtalar bilan korroziya - mahalliy korroziya turlari vayron qilingan maydon diametrining uning chuqurligiga nisbati bilan farqlanadi (1., 4-6-rasm). Spotli korroziya bilan vayron qilingan maydonning diametri uning chuqurligidan ancha katta, yarali vayron bo'lganda, vayron qilingan maydonning diametri uning chuqurligiga mos keladi va chuqur korroziya bilan vayron qilingan maydonning diametri uning chuqurligidan ancha past bo'ladi. . Ba'zi hollarda chuqurlik korroziyasi halokatga olib kelishi mumkin, bu ayniqsa quvurlar, tanklar va boshqalar uchun xavflidir. Pitting korroziyasi passivatsiyaga qodir bo'lgan metallar uchun xosdir - tormozlash (xrom, alyuminiy, zanglamaydigan po'latlar va boshqalar). Metalllarning passiv holati sirtning ma'lum zaif joylarida, masalan, himoya plyonkaning teshiklarida, intermetalik qo'shimchalar (oksidlar, shlaklar va boshqalar) joylarida buzilishi mumkin. SELANLAVCHI KOROZIYON – quyidagilarga bo‘linadi: komponentli-selektiv (selektiv) yoki strukturali-selektiv (kristallararo). 8 KOMPONENT-TALANLAVCHI KOROZIYONga misol sifatida guruchning sinksizlanishini keltirish mumkin. Guruchni sinksizlantirish3 sinkning misga qaraganda elektrolitga (odatda neytral yoki ozgina kislotali pH qiymatida) intensiv ravishda o'tishidan iborat. Guruch yuzasida bo'shashgan mis qatlami hosil bo'lib, bu elektrokimyoviy korroziyaning kuchayishiga yordam beradi (mikrogalvanik hujayraning paydo bo'lishi). TUZILMA-SELANLAVCHI korroziyaga misol sifatida kulrang quyma temirning korroziyasini keltirish mumkin. Kulrang quyma temirning konstruktiv selektiv korroziyasi ferrit komponentini ustun ravishda yo'q qilishdan iborat bo'lib, natijada korroziya mahsulotlari bilan to'ldirilgan grafit skeleti hosil bo'ladi (1-3-rasm). Shu bilan birga, quyma temirning mexanik mustahkamligi keskin kamayadi. INTERKRISTALLIT KOROZIYASI metallning don chegaralari bo'ylab tanlab yo'q qilinishi bilan tavsiflanadi (1-7-rasm). Natijada, massa va tashqi ko'rinishning kichik o'zgarishi bilan metallning mustahkamlik xususiyatlarini juda sezilarli darajada yo'qotishi mumkin (2-rasm). 40-rasm. 2. Har xil turdagi korroziyani yo'q qilishda metallning mustahkamlik xususiyatlarini yo'qotish 1 - bir xil korroziya; 2 – donalararo korroziya 20 w ning yo'qolishi, % 60 2 0 1 2 4 Og'irlikning yo'qolishi, kg/sm2 O'ta og'ir holatlarda, donalararo korroziya natijasida don chegaralarini to'liq yo'q qilish bilan qotishma kukunga aylanishi mumkin. KOROZIYON YORISH - mahalliy korroziya holati bo'lib, unda buzilish eng katta kuchlanish kuchlanishiga perpendikulyar yo'nalishda sodir bo'ladi (1 - 8-rasm). 3 Guruch - mis-sink qotishmasi. 9 Odatda, bu holda korroziya yorilishi don chegaralari bo'ylab tarqalishi yoki kristall tanasini kesishi mumkin. Korroziyadan charchoqni yo'q qilish (bir vaqtning o'zida korroziy muhit va o'zgaruvchan yoki tsiklik yuklarga ta'sir qilish bilan) korroziya yorilishi paytida bo'lgani kabi davom etadi. Er osti korroziyasi, asosan, sirtdan boshlanib, asosan sirt ostida tarqaladi, bu ko'pincha metallning delaminatsiyasiga va shishishiga olib keladi (1− 9-rasm), masalan, qirqish jarayonida past sifatli metall lavhada pufakchalar paydo bo'ladi. yoki idishlar va apparatlarning ishlashi paytida korroziya. 1.4. Korroziya ko'rsatkichlari Korroziya tezligini miqdoriy aniqlash uchun korroziya ko'rsatkichlari qo'llaniladi: MASSOMETRIC, VOLUMETRIC, CHURURK, MEXANIK, HOZIR. 2 MASSOMETRIK korroziya ko'rsatkichi (Km, g/m ∙h) - namunaning birlik yuzasi (lar)ida va vaqt birligida korroziya natijasida metall massasining o'zgarishi. Namuna massasining o'zgarishi odatda namunaning sinovdan oldingi massasi (mo) va sinovdan keyingi massasi (m1) vaqt o'tishi bilan (t) o'rtasidagi farq sifatida aniqlanadi (t) korroziya mahsulotlarini olib tashlash (metall massasining yo'qolishi). . K m = (m0 - m1)/s ∙ t . (4) 3 2 VOLUMETRIK korroziya indeksi (Kn, sm /m h) - korroziya jarayonida yutilgan yoki ajralib chiqadigan gazning hajmi (Vo), metall sirt birligi va vaqt birligi uchun K m = V0 / s ∙ t. (5) DEPTH korroziya indeksi (P, mm / yil) chiziqli birliklarda va vaqt birligida ifodalangan korroziya tufayli metall qalinligining pasayishini hisobga oladi. Bu ko'rsatkich turli zichlikdagi metallarning korroziyasini solishtirishda foydalidir. Massometrik indikatordan chuqurlikka o'tish bir xil korroziya holatida P = K m ∙ 8,76 /g formulasi yordamida amalga oshirilishi mumkin, (6) bu erda g - metallning zichligi. MEXANIK korroziya ko'rsatkichi korroziya jarayonining ma'lum bir vaqtida metallning mexanik xususiyatlarining asosiy ko'rsatkichlaridan birining o'zgarishi bilan aniqlanadi va nisbiy birliklarda yoki foizlarda ifodalanadi. Agar kuchlanish kuchi mexanik ko'rsatkich sifatida ishlatilsa, u holda mustahkamlik ko'rsatkichining o'zgarishi (Ks) Ks = Dsb/sb formulasi bilan aniqlanadi, (7) bu erda sb - korroziyaga qadar cho'zilish kuchi, ∆sb - t vaqt ichida korroziyadan keyin metallning valentlik kuchining o'zgarishi. Joriy korroziya ko'rsatkichi Faraday formulasidan foydalanib, korroziya oqimining kattaligiga qarab korroziyalangan metall miqdorini hisoblash imkonini beradi Km = IA /nF, (8) bu erda Km - o'zgarishlarga asoslangan korroziya tezligi. metall massasida; I - joriy quvvat; F – Faraday doimiysi; n – metallning valentligi; A - metallning atom massasi. Metalllarning korroziyaga chidamliligini sifat va miqdoriy jihatdan baholashda o'n balli shkaladan foydalanish tavsiya etiladi4. Shuni ta'kidlash kerakki, metallarning korroziyaga chidamliligini baholash uchun ushbu shkala, ayniqsa kimyo sanoatida keng tarqalgan bo'lsa-da, u universal emas, chunki turli maqsadlar uchun uskunalar uchun ruxsat etilgan korroziya darajasi kattalik yoki kattalik tartibida farq qilishi mumkin. Ko'proq. 1-jadval Metall va qotishmalarning korroziyaga chidamliligining balli shkalasi. Qarshilik guruhi to'liq turg'un, juda chidamli past chidamli beqaror korroziya tezligi, mm / yil 0,001 dan 0,001 dan 0,005 gacha 0,01 dan 0,05 dan 0,05 gacha. 0,1 dan 0,1 dan 0,5 gacha 0,5 dan 1,0 gacha 1,0 dan 5,0 gacha 5,0 dan 10,0 gacha 10,0 dan yuqori ball 1 2 3 4 5 6 7 8 9 10 Korroziya va qarishdan himoya qilishning yagona tizimi. Er osti inshootlari. Korroziyadan himoya qilish uchun umumiy talablar. GOST 9.602−2005, http://www.gosthelp.ru/gost/gost206.html 4 11 2-bob. METALLARNING KIMYOVIY KOROZİYASI Metalllarning kimyoviy korroziyasi - tashqi muhit bilan kimyoviy o'zaro ta'sir natijasida ularning o'z-o'zidan nobud bo'lish jarayoni. Kimyoviy korroziya jarayonining o'ziga xos xususiyatlari quyidagilardan iborat: – oksidlanish va qaytarilish jarayonlarini bir bosqichda amalga oshirish; - elektr tokining yo'qligi; - korroziya mahsulotlarining to'g'ridan-to'g'ri vayron bo'ladigan sirt maydonida shakllanishi. KIMYOVIY KOROZIYON - suyuqlik (l) yoki gaz fazasi (g)ning qattiq faza (lar) - metall bilan o'zaro ta'sirining geterogen reaktsiyasi bo'lib, 2 turga bo'linadi (gaz korroziyasi, suyuq bo'lmagan elektrolitlardagi korroziya). 2.1. Gaz korroziyasi Amalda eng katta ahamiyatga ega bo'lgan gaz korroziyasidir. Ko'pincha, u kislorod o'z ichiga olgan gazlar atmosferasida yuqori haroratlarda (suvning qaynash nuqtasidan o'nlab marta yuqori) metall materiallarning korroziyasi sifatida namoyon bo'ladi. Shuning uchun u YUQORI HARORATLI KOROZIYON yoki YUQORI HARORATLI OKSIDLANISH deb ataladi. Metall va qotishmalardan tayyorlangan buyumlar yuzasida ularning bunday korroziy muhit bilan o'zaro ta'siri natijasida turli xil metall oksidlarini ifodalovchi mahsulotlar plyonkasi hosil bo'ladi. Shu bilan birga, ish sharoitlariga qarab, boshqa birikmalar hosil bo'lishi mumkin, masalan, oltingugurt metallari5. Masalan, neftni qayta ishlash sanoatida gaz korroziyasi, masalan, vodorod sulfidi, uglerod oksidi, azot, kislorod va boshqa gazlar yuqori haroratda ta'sir qiladigan o'choq quvurlari, reaktor devorlari, reaksiya ustunlari va boshqa uskunalarga ta'sir qiladi. "Gaz korroziyasi" atamasi yuqori haroratlarda bug'lar va gazlarning ta'siridan kelib chiqqan metallarning yo'q qilinishini anglatadi, garchi u sulfidlar kabi 5 oltingugurtli metallda past haroratlarda ham qo'llanilishi mumkin. 12 elektr tokini o'tkazuvchi suyuqlik plyonkasi metall ustida kondensatsiyalanmasligini ta'minlash. Metall va qotishmalardan tayyorlangan buyumlar yuzasida ularning korroziy muhit bilan o'zaro ta'siri natijasida turli xil metall birikmalarini ifodalovchi mahsulotlar plyonkasi hosil bo'ladi. Umuman olganda, kimyoviy korroziya jarayonini, masalan, metall oksidlanishining qizdirilgan (T >>373K) gaz (G2) bilan reaksiyasi bilan tavsiflanishi mumkin: 2Me + nG2 → 2Men+Gn. Kislorodli muhitda bunday jarayonni quyidagi Me(T) + ½ O2 ↔ MeO(T) tenglama bilan tavsiflash mumkin. Bu reaktsiya yuqori haroratlarda muvozanatdir. Teskari jarayon OKSİD DISSOTSIYAlanishi deb ataladi. Gazsimon muhitda mavjud bo'lgan kislorod uning qisman bosimi (pO2) bilan tavsiflanadi. Kislorodning parsial bosimi (pO2) va OKSID DISSOTSIYALANISHINI ELASTIKLIGI (pMeO)7 teng bo'lsa (pMeO = pO2) 1. pO2 > pMeO bo'lganda, reaksiya davom etsa, metall oksidlanishining kimyoviy reaktsiyasi oksidning dissotsilanish reaktsiyasi bilan muvozanatda bo'ladi. asosan oksid hosil bo'lish yo'nalishida. pMeO > pO2 bo‘lganda reaksiya asosan teskari yo‘nalishda boradi. Metalllarning oksidlanishi ko'p bosqichli geterogen jarayon bo'lib, buning natijasida sirtda avval mono-, so'ngra polimolekulyar oksid qatlami, oksid plyonkasi deb ataladigan qatlam hosil bo'ladi. Uning qalinligining o'sishi bir vaqtning o'zida ikkala yo'nalishda ham (metall va gazsimon muhitda) yoki asosan bittada sodir bo'lishi mumkin (3-rasm). PARTIAL BOSIM (kech lotincha partialis - qisman), gaz aralashmasi tarkibiga kiradigan gaz, agar u bir xil haroratda aralashmaning hajmiga teng hajmni egallagan bo'lsa, qanday bosim. 7 OKSIDLARNING hosil bo'lish yoki ISSILIK DISSOTSIALANISH reaktsiyalari uchun kislorodning muvozanat parsial bosimi OKSIDLAR DISSOTSIALANISHNING ESLIKLIGI deb ataladi. Uning qiymati reaksiyaning muvozanat konstantasi bilan bog'liq va shuning uchun haroratning funktsiyasidir. 6 13 a b c rasm. 3-rasm. Metall qism yuzasida oksid plyonkasi hosil bo'lishi va o'sishining ion-elektron mexanizmining sxemasi Agar o'sish gazsimon muhit yo'nalishi bo'yicha sodir bo'lsa, u holda qismning kattaligi sezilarli darajada o'sishi kuzatiladi , masalan, oksidlanish jarayonida, bu mashinasozlikda hisobga olinishi kerak. O'sish yo'nalishi metall ionlarining Men+ va kislorod O2− oksid plyonkasi ichidagi qarshi diffuziya tezligi o'rtasidagi nisbat bilan belgilanadi. Agar metall ionlarining (rdif.Me) va kislorodning (rdif.O2) diffuziya tezligi bir-biridan katta farq qilsa, oksid plyonkasining o'sishi asosan bir yo'nalishda, masalan, rdiff.O2 bilan sodir bo'ladi.< rдиф.Mе − в направлении газовой среды и наоборот (рис. 3, в, б). В большинстве случаев, скорости диффузии ионов металла и кислорода соизмеримы, но для ионов кислорода скорость несколько ниже из−за того, что они больше по размерам, поэтому зона роста, находящаяся в толще самой оксидной пленки, располагается ближе к ее внешней поверхности (рис. 3, а). По мере утолщения оксидной пленки процессы встречной диффузии ионов и электронов затрудняются. С повышением температуры упругость диссоциации оксидов возрастает у всех металлов. Поэтому, начиная от какой−то температуры, когда упругость диссоциации оксида металла становится больше парциального давления кислорода в воздухе (при атмосферном давлении рО2 = 0,21 ат), металл перестает окисляться и становится вполне малоактивным по отношению к кислороду. Так, например, серебро при температуре 300 ºК термодинамически еще не устойчиво, а при 400 ºК и при всех более высоких температурах упругость диссоциации Ag2O превышает парциаль14 ное давление кислорода в воздухе. При температуре 2000 ºК медь тоже становится неокисляемым металлом, однако для таких металлов, как Fе, Zn, Ni и др., даже при этих температурах упругость диссоциации окислов остается еще достаточно низкой и, следовательно, протекание реакции окисления вероятно. Необходимо учесть, что температурная зависимость для кинетики процесса окисления совершенно иная, чем для термодинамической вероятности окисления. Поэтому нет никакого противоречия в том, что термодинамическая вероятность окисления металла с повышением температуры падает, а реальная скорость окисления (при условии, что термодинамически этот процесс остается еще возможным) с повышением температуры возрастает. 2.2. Образование тонких пленок на металлах Ранее было отмечено, что в большинстве случаев образовавшиеся продукты газовой коррозии – оксиды металла остаются на поверхности металла в виде пленки. Эти пленки определяют кинетику процесса и в случае наличия защитных свойств могут привести к замедлению коррозии. Чтобы пленка оксида металла обладала защитными свойствами, она должна быть: − сплошной; − прочно сцепляться с основным металлом и обладать близким к нему коэффициентом теплового расширения; − быть химически инертной по отношению к данной агрессивной среде; − обладать твердостью и износостойкостью. Даже при обычной температуре на поверхности многих металлов и сплавов на воздухе образуются слои оксидов. Еще в 1836 г. М. Фарадей высказал предположение, что даже на блестящей поверхности металлов существует тончайшая, невидимая защитная (оксидная) пленка. Этим он объяснял пассивность железа в азотной кислоте. Если пленка пористая, рыхлая и характеризуется плохим сцеплением с основным металлом, то даже при условии инертности в данной агрессивной среде, она не будет обладать защитными свойствами. Пленки по толщине (δ) делятся на три группы: − тонкие (невидимые), δ < 4000 нм; − средние (дающие цвета побежалости), δ = от 4000 до 50000 нм; 15 − толстые (видимые), δ > 50000 nm. Metallning quruq havo bilan o'zaro ta'sirida hosil bo'lgan plyonkalarning qalinligi har xil va metallning turiga, haroratga va boshqa omillarga bog'liq. Shunday qilib, xona haroratida mis va temir ustidagi plyonkalarning qalinligi 100-300 nm, alyuminiyda esa 1000-1500 nm. Metalllarda yupqa plyonkalar mavjudligini isbotlovchi bir nechta misollar keltiramiz. 1. Temir plitaning toza yaltiroq yuzasi bir uchi qizdirilsa, unda interferentsiya ranglari paydo bo'ladi - "xira ranglar". Bu turli qalinlikdagi oksidlarning ko'rinishini ko'rsatadi. Ranglar quyidagi tartibda bo'ladi - plastinkaning sovuq uchidan mos ravishda issiqgacha: sariq, to'q sariq, qizil, binafsha, binafsha, ko'k. Mis nitrat eritmasi tomchilari yordamida hosil bo'lgan plyonkaning himoya xususiyatlarini sinashda, plyonka zaif himoya xususiyatlariga ega bo'lgan joylarda u temir bilan reaksiyaga kirishadi: Cu(NO3)2 + Fe → Fe(NO3)2 + Cu. Natijada, tomchilar ostidagi sirtda mis paydo bo'ladi. Reaktsiya sodir bo'lgan vaqtga kelib, turli sohalarda filmlarning himoya xususiyatlarini baholash mumkin. Ushbu tajribada eng yaxshi himoya xususiyatlari isitish joyidan uzoqda joylashgan (sariq zonaning orqasida), sirt o'zgarishsiz qoladigan hududda topiladi. Ko'rinib turibdiki, bu sohada isitiladigan joylarga nisbatan juda nozik, ammo zichroq plyonka mavjud. 2. Agar simob ostida ignani (yoki ustarani) sindirsangiz, singan joylarda amalgam hosil bo'ladi. Singan namunalar simobda havoga joylashtirilsa, amalgamatsiya kuzatilmaydi. Bu birikmani oldini oladigan juda nozik oksidli plyonka hosil bo'lishi bilan izohlanadi. 3. Temirni kaliy gidroksidning ortiqcha yodli eritmasiga solinganda eritmadagi temir yuzasida chuqur tirnalish hosil bo'ladi. Bir muncha vaqt o'tgach, tirnalgan joyda temir eriydi va shisha tagida yoriqlar qoladi, keyingi tekshiruvdan keyin temir (III) oksidi bo'lib chiqadi. Metall ustida plyonka hosil bo'lish jarayoni bosqichma-bosqich sodir bo'ladi. 16 Metallning korroziy muhit bilan o'zaro ta'siri jarayonining birinchi bosqichi oksidlovchi moddaning (O2, CO2, H2O, SO2) metall yuzasida xemisorbsiyasidir, masalan: Me(sol) + (O2) = Me( sol) + 2Oads. Metall va oksidlovchi modda o'rtasida kimyoviy yaqinlik mavjud bo'lganda, metallning korroziy muhit bilan o'zaro ta'sirining ikkinchi bosqichi - kimyosorbsiyalangan plyonkaning oksidga o'tishi amalga oshiriladi. Bu jarayonni shartli ravishda quyidagi ko'rinishdagi reaksiya bilan tavsiflash mumkin: xMe(s) + yOads = MexOy. Metall yuzasida hosil bo'lgan oksidli plyonka oksidlovchi metallning yuzasiga oksidlovchi vositani etkazib berishni inhibe qilish tufayli korroziya jarayonini sekinlashtirishi mumkin. Bunday holda, film HIMOYA XUSUSIYATLARIGA ega. 2.2.1. Metalllardagi plyonkalarning uzluksizligi sharti Faqat DAVOMLI FILMLAR himoya xususiyatlariga ega bo'lishi mumkin. Bunday plyonkaning hosil bo'lish imkoniyati Pilling-Bedworth UZMALIK SHARTI bilan belgilanadi. Metall yuzasida paydo bo'ladigan birikmaning molyar hajmi (Vok) birikmaning bir molini hosil qilish uchun sarflangan metall hajmidan (VMe) katta bo'lishi kerak: Vok/VMe >1. Agar Vok/VMe< 1, то пленка не может быть сплошной. К металлам, не удовлетворяющим условию сплошности при окислении их кислородом, относятся щелочные и щелочно−земельные металлы. Сплошность пленок – необходимый, но недостаточный фактор, определяющий ее защитные свойства. Как показал Францевич И. Н., у пленок с Vok/VMe >>1 yuqori himoya xususiyatlariga ega bo'lolmaydi, chunki ularda katta ichki stresslar paydo bo'ladi (masalan, MoO3 yoki WO3). Ovoz nisbatining yuqori chegarasi 2,5 deb qabul qilinadi. Keyin aniqlangan uzluksizlik sharti quyidagicha ko'rinadi: 1< Vok/VMe < 2,5. 2.2.2. Законы роста оксидных пленок на металлах Процесс роста ПОРИСТОЙ ПЛЕНКИ не осложняется процессом подвода окислителя к поверхности металла, а контролируется скоростью химической реакции образования оксида. Скорость коррозии в этом случае выражается уравнением: 17 V = dx/d = kC, где x − толщина пленки; – время; k − константа скорости химической реакции образования оксида; C − концентрация окислителя на поверхности метала. Рост пористой пленки, контролируемый скоростью химической реакции окисления металла, протекает во времени ПО ЛИНЕЙНОМУ ЗАКОНУ. Линейный закон роста имеет место: − при высокотемпературном окислении на воздухе и в среде кислорода при Vok/VMe<1; − в случае образовании летучих оксидов. Сплошные пленки затрудняют проникновение реагентов друг к другу и их рост сопровождается самоторможением процесса. Результирующая скорость этого сложного процесса определяется скоростью самой медленной стадии, т.е. возможны различные варианты контроля течения процесса. 1−й вариант. Скорость коррозии контролируется стадией массопереноса (диффузионный контроль процесса). В этом случае концентрация окислителя на границе раздела Ме – оксидная пленка равна нулю, так как скорость химической реакции весьма велика. Уравнение скорости течения коррозии определяется ПАРАБОЛИЧЕСКИМ ЗАКОНОМ роста оксидной пленки. Параболический закон роста реализуется, в частности, при окислении железа на воздухе при различных температурах. 2−ой вариант. В предыдущем случае С = 0, т.е. накопление окислителя на внутренней поверхности оксидной пленки не происходит. Если учесть возможность кинетического торможения процесса роста оксидной пленки наряду с торможением на стадии массопереноса (диффузионно−кинетический контроль процесса), в этом случае приходим к СЛОЖНО − ПАРАБОЛИЧЕСКОМУ ЗАКОНУ роста оксидной пленки. Рост оксидных пленок по сложно−параболическому закону выполняется: а) при окислении железа в парах воды или в атмосфере СО2; б) при окислении Сo, Сu в атмосфере чистого кислорода; в) при частичном разрушении оксидной пленки. Рост оксидных пленок при диффузионно−кинетическом контроле может быть выражен ТАКЖЕ СТЕПЕННЫМ ЗАКОНОМ. 18 3−й вариант. Часто рост пленки протекает медленнее, чем это следует из параболического закона роста. Это наблюдается при возникновении оксидных пленок при низких температурах (на Сu в О2 при t < 100 оС; на Аl, Тi, Ni, Zn в О2 при t = 300400 оС.) Затухание объясняется либо уплотнением пленок, либо появлением дефектов (пузырей, расслоений). В этих случаях рост толщины пленки протекает в соответствии с логарифмическим законом роста: x = ln(K). 2.3. Термодинамика процесса химической коррозии В качестве примера рассмотрим процесс окисления металла в атмосфере кислорода. Процесс окисления металла может быть представлен реакцией вида: 2Ме + nО2 → Me2n+Оn. Движущая сила процесса коррозии (ДСП) может быть определена с помощью термодинамики. Торможение процесса (ТП) не может быть определено термодинамически, однако с помощью термодинамики можно оценить условия, уменьшающие или исключающие протекание процесса (применение защитных сред, катодная защита, обескислороживание и др.). Независимо от механизма коррозии возможность ее протекания определяется знаком изменения термодинамического потенциала (см. раздел 1.1). Любое изменение энергии системы характеризует переход ее в новое состояние и является мерой стабильности системы: ΔG = GII − GI , где ΔG – энергия, израсходованная на изменение состояния системы, например, на процесс коррозии; GI − энергия системы в исходном состоянии, например, металла в конкретных условиях; G II − энергия системы в новом состоянии, например, прокорродировавшего металла. Рассчитать ΔG можно, вспомнив начало химии8. Величину изобарно-изотермического потенциала можно рассчитать по разности между суммами Δ G продуктов реакции и исходных веществ: GХР = ΔG ni – ΔG mi. (прод. р-ции) (исх. в-в). ΔG - является функцией температуры. Стандартные значения для большинства веществ сведены в справочные таблицы термодинамических величин. Изменение энергии Гиббса в зависимости от температуры учитывается уравнением Гиббса. ΔG Т = ΔН 298 – 298 Δ S 298. ΔG простого вещества = 0. Определить энергию Гиббса для любой химической реакции можно по уравнению ΔG = ΔG + RТ ln К, рассчитав предварительно величину константы равновесия, например, по равновесным концентрациям веществ. При равновесии ΔG=0, поэтому ΔG+RТlnК=0, следова8 19 2.4. Кинетика процесса химической коррозии Хотя термодинамика и дает ответ на вопрос о том, насколько изучаемая система отдалена от состояния равновесия, но ответ на весьма важный практический вопрос о скорости протекания коррозионного разрушения в рамках термодинамики получен быть не может. Рассмотрением этого вопроса и занимается кинетика коррозионных процессов. 2.4.1. Скорость процесса коррозии. Показатели химической коррозии СКОРОСТЬ КОРРОЗИОННОГО процесса может быть представлена в общем виде с помощью уравнения: СКОРОСТЬ КОРРОЗИИ (СК) = ДСП / ТП, где ДСП − движущая сила процесса; ТП − торможение процесса. Скорость химической коррозии определяют количественно по наблюдениям во времени за изменением какой−либо подходящей для этих целей величины, изменяющейся в процессе коррозии. Тогда истинная скорость коррозии металлического материала определяется из выражения: V = dy/d, где y − изменяющаяся в процессе коррозии характеристика свойств материала; − время коррозии. Для количественного выражения скорости коррозионных разрушений на практике пользуются показателями коррозии, являющимися, по сути, отражением СРЕДНЕЙ СКОРОСТИ КОРРОЗИОННОГО разрушения материала: Vср=∆y/∆. Показатели коррозии. 1. ГЛУБИННЫЙ ПОКАЗАТЕЛЬ коррозии: Kn=∆П/∆, где ∆П − глубина (средняя или максимальная) коррозионного разрушения; ∆ − промежуток времени коррозии. 2. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ ТОЛЩИНЫ образующейся на металле пленки продуктов коррозии: Kn= ∆h/∆, где ∆h − изменение толщины образующейся на металле пленки продуктов коррозии. тельно, ΔG = – RТlnК. Данное уравнение позволяет также определить значение константы равновесия химической реакции по величине изобарно-изотермического потенциала. Для определения направления протекания многих химических реакций достаточно оценить знак Δ G. 1). При ΔН 0 , Δ S 0 реакция самопроизвольна (Δ G 0) при Т. 2). При ΔН 0, Δ S 0 реакция обратная (Δ G 0) при любой Т. 3). При ΔН 0, Δ S 0, реакция самопроизвольна (Δ G 0) при любой Т. 4). При ΔН 0, ΔS 0 реакция самопроизвольна (Δ G 0) при Т. 20 3. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ МАССЫ Km=∆m/S∆, где ∆m − изменение массы корродирующего металла; S – площадь поверхности коррозии. 4.ОБЪЕМНЫЙ ПОКАЗАТЕЛЬ КОРРОЗИИ Kv=∆V/S∆, где ∆V − объем газа, выделившегося или поглощенного в процессе коррозии и приведенный к нормальным условиям. 5. МЕХАНИЧЕСКИЙ ПОКАЗАТЕЛЬ КОРРОЗИИ Кs=(∆s/∆)100 %, где ∆s − относительное изменение характеристики механического свойства. 6. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ ЭЛЕКТРИЧЕСКОГО СОПРОТИВЛЕНИЯ KR=(∆R/∆)100 %, где ∆R − относительное изменение электросопротивления образца. 2.4.2. Влияние внешних факторов на химическую коррозию металлов Скорость и характер процесса химической коррозии металлов зависит от ряда факторов. ВНЕШНИМИ ФАКТОРАМИ называют те, которые связаны с составом коррозионной среды и условиями коррозии (температура, давление, скорость перемещения коррозионной среды и т.д.). Температура − мощный внешний фактор коррозии. Характер влияния температуры на скорость окисления металла определяется зависимостью константы скорости реакции окисления (k) и диффузии (D) от температуры. И k = f(T) и D = f(T) описываются одним и тем же уравнением (уравнение Аррениуса): k = k0 exp (−E/RT), (9) где k0 − константа; Е − энергия активации химической реакции. D = D0 exp (−E1/RT), (10) 1 где D0 – константа; Е − энергия активации диффузии. Таким образом, вне зависимости от вида контролирующей стадии процесса окисления с повышением температуры скорость окисления резко возрастает. Колебания температуры, особенно переменный нагрев и охлаждение, увеличивают скорость окисления металла, так как в защитной пленке образуются трещины. Состав газовой фазы. Влияние состава газовой фазы на скорость коррозии металла велико, специфично и изменяется с изменением температуры. В частности, на скорость окисления железа и 21 стали особенно сильно влияют кислород, соединения серы, водяные пары. Приведенные ниже данные свидетельствуют о зависимости увеличения относительной скорости коррозии стали с 0,17 % углерода от состава газовой фазы при 900 оС: Состав газовой фазы Кислород Чистый воздух Чистый воздух + 2 % SO2 Чистый воздух + 5 % H2O Чистый воздух + 5 % SO2+ 5 % H2O % 200 100 118 134 276 Значительное влияние на коррозию сталей и сплавов оказывают продукты горения топлива, содержащие ванадий (например, V2O5). Это соединение находится в золе от сжигания дешевого топлива − мазута, нефтепродуктов. Зола, налипая на металл, увеличивает скорость его коррозии в десятки раз. Причина этому – «ванадиевая коррозия», обусловленная легкоплавкостью V2O5, и его способностью ОФЛЮСОВЫВАТЬ (переводить в жидкое состояние) химические соединения золы и окалины. Пятиокись ванадия участвует в процессе окисления железа: 4Fe + 3V2O5 = 2Fe2O3 + 3V2O3, V2O3 + O2 = V2O5, V2O5 + Fe2O3 = 2FeVO4. Повышение содержания СО в газовой фазе понижет скорость коррозии углеродистых и низколегированных сталей, но при больших количествах СО в газовой фазе может произойти науглероживание поверхности стали. При этом возможны следующие химические реакции: 2CO + O2 = 2CO2, 2CO = Cсаж + CO2. Давление окислителя. Если бы поверхность металла не была покрыта оксидной пленкой, то скорость окисления была бы пропорциональна парциальному давлению окислителя (для двухатомных газов – PГ2). Так как поверхность металла покрыта слоем оксида, то зависимость скорости окисления от величины парциального давления окисляющего газа определяется строением защитной пленки. В то же время при окислении железа при 700 − 950о С скорость окисления не зависит от парциального давления Po2. 22 Скорость движения газовой фазы. Окисление как гетерогенный процесс определяется скоростью подвода и отвода реагентов в зону реакции. Поэтому, чем больше скорость движения потока газа, тем больше и скорость окисления металла. Режим нагрева металла. Влияние режима нагрева металла может быть рассмотрено в зависимости от влияния колебаний температуры. Иначе говоря, переменные нагрев и охлаждение увеличивают скорость окисления ввиду нарушения сохранности защитной пленки. 2.4.3. Влияние внутренних факторов на химическую коррозию металлов ВНУТРЕННИМИ называют факторы, связанные с составом, структурой, внутренними напряжениями в металле, качеством обработки поверхности металла и др. Состав сплава. Применительно к наиболее важным конструкционным сплавам на основе железа для случая газовой коррозии можно отметить следующее. 1. При высоких температурах (более 800оС) с увеличением содержания углерода в стали скорость ее окисления и обезуглероживания уменьшается вследствие более активного образования СО, что снижает окислительный потенциал газовой фазы. 2. Сера фосфор, никель, марганец практически не влияют на скорость окисления железа. 3.Титан, медь, кобальт, бериллий заметно снижают скорость окисления железа. 4. Хром, алюминий, кремний сильно замедляют окисление железа. 5. Ванадий, вольфрам и молибден могут значительно ускорить окисление стали, которое иногда носит катастрофический характер. Структура сплава. Анализ экспериментальных данных свидетельствует о том, что чем меньше в сплаве структурных составляющих, тем выше его жаростойкость. Применительно к сплавам железо – углерод наиболее устойчивой является АУСТЕНИТНАЯ СТРУКТУРА9. Аустенит (γ-фаза) − высокотемпературная гранецентрированная модификация железа и его сплавов. В углеродистых сталях аустенит − это твѐрдый раствор внедрения, в котором атомы углерода входят внутрь элементарной ячейки γ-железа во время конечной термообработки. В сталях, содержащих другие металлы (кроме железа, легированные стали), атомы металлов замещают атомы железа в кристаллической решетке, и возникает твердый раствор замещения. Фаза названа в честь сэра Уильяма Чандлера Робертс-Остина (англ. William Chandler Roberts-Austen, 1843 − 1902). 9 23 Всего различают пять больших групп нержавеющих сталей, определяемых их микроструктурой. Наиболее распространенными являются три: АУСТЕТНИТНЫЕ (AUSTENITIC) − не магнитная сталь с основными составляющими 15−20 % хрома и 5−15 % никеля, который увеличивает сопротивление коррозии. Она хорошо подвергается тепловой обработке и сварке. Обозначается буквой A в начале наименования марки. Именно аустенитная группа сталей наиболее широко используется в промышленности и в производстве элементов крепежа. МАРТЕНСИТНЫЕ (MARTENSITIC) − значительно более твердые, чем аустетнитные стали и могут быть магнитными. Они упрочняются, закалкой и отпуском подобно простым углеродистым сталям и находят применение главным образом в изготовлении столовых приборов, режущих инструментов и общем машиностроении. Больше подвержены коррозии. Обозначаются буквой С. ФЕРРИТНЫЕ (FERRITIC) стали значительно более мягкие чем мартенситные по причине малого содержания углерода. Они также обладают магнитными свойствами. Обозначаются буквой F. Стали с двухфазной АУСТЕНИТНО−ФЕРРИТНОЙ СТРУКТУРОЙ менее устойчивы против окисления. Их меньшая жаростойкость связывается с большей неоднородностью образующейся защитной пленки, что приводит к ее разрушению при росте (неоднородность возникающих внутренних напряжений). Так хромоникелевые стали с однофазной аустенитной структурой более устойчивы против окисления, чем двухфазные: Х12Н12М2Т, Х12Н9Т ведут себя лучше, чем ОХ21Н5МД2Т или 1Х21Н5Т 2]. На жаростойкость10 чугунов кроме их состава влияет и структура. Существенное влияние оказывает форма графитных включений. Так, при шаровидной форме графита стойкость против окисления выше, чем при пластинчатой. Установлено, что предварительная холодная пластичная деформация несколько ускоряет окисление металла вследствие повышения запаса его энергии. Чем тщательнее обработана поверхность металла, тем меньше скорость его окислеЖаростойкость − окалиностойкость, способность металлических материалов противостоять химическому разрушению поверхности под воздействием воздушной или иных газообразных сред при высоких температурах. 10 24 ния, что обусловлено лучшей сохранностью защитных пленок на гладкой поверхности. 2.5. Некоторые случаи газовой коррозии металлов в технологических средах В химической промышленности многие технологические процессы или их определенные стадии протекают в газовой среде в условиях повышенных температур и давлений (рис.4). При температурах от 100 до 200 − 300 °С многие газы не опасны. Химическая активность газов и скорость газовой коррозии металлов сильно возрастают при температурах выше 200 − 300 °С. Так, Cl2 начинает действовать на железные сплавы при Рис. 4. Некоторые случаи газовой температуре > 200 °C, HCl -> metalllarning texnologik korroziyasi - 300 °C, SO2, NO2, oltingugurt bug'lari. > 500 °C. Texnologik gaz muhitlari xatti-harakatlarining bu xususiyatlari va ularni sanoatda keng qo'llash real sharoitlarda metallarning xatti-harakatlarini batafsilroq ko'rib chiqishni talab qiladi. 2.5.1. Temir, quyma temir va po'latlarning O2, CO2, H2O bug'lari atmosferasida korroziyasi Yuqori haroratlarda havo kislorodining temir-uglerod qotishmalariga ta'siri temirning shkala hosil bo'lishi bilan oksidlanishiga, po'latning dekarburizatsiyasiga va o'sishiga olib keladi. quyma temirdan. Temirning yuqori haroratda oksidlanishi natijasida SCALE deb ataladigan korroziya mahsulotlari qatlami hosil bo'ladi. Skala murakkab tuzilishga ega va bir nechta oksidlarni o'z ichiga oladi: Fe3O4 - MAGNETITE murakkab shpinel kristalli panjaraga ega; Fe2O3 – GEMATIT rombedral panjaraga ega; FeO - VUSTIT nuqsonli kristall panjara tuzilishiga ega. Vustit 575 oS dan yuqori haroratda hosil boʻladi va sekin soviganida parchalanadi: 4FeO Fe3O4 + Fe. 25 575 °C dan pastda shkalada vustit yo'q va Fe3O4 qatlami to'g'ridan-to'g'ri po'lat yuzasiga ulashgan. Po'lat oksidlanish tezligi (2.4.1-bo'limga qarang) ko'rsatkichga yaqin qonunga muvofiq (5-rasm) harorat oshishi bilan ortadi va koordinatalarda logk - 1 / T singan chiziq bilan ifodalanadi, uning har bir uzilishi mos keladi. ba'zi transformatsiyalar. Shunday qilib, 575 ºC haroratda shkalada kislorodning tarqalishiga xalaqit bermaydigan vustit FeO ning pastki qatlami paydo bo'ladi, buning natijasida jarayonning faollashuv energiyasi ortadi va metall oksidlanish tezligi oshadi. ~ 900 ºS haroratda egri chiziqdagi uzilish po'latning allotropik o'zgarishiga to'g'ri keladi. Po'latning oksidlanish tezligining haroratga bog'liqligining o'zgarishi tabiati ostenitik strukturaning issiqlikka chidamliligini ko'rsatadi, bunda harorat oshishi bilan oksidlanish tezligining sekinroq o'sishi kuzatiladi. Po'lat va quyma temirda oksidlanish bilan birga karbonsizlanish jarayoni sodir bo'ladi - ular tarkibidagi temir karbidning kislorod va kislorod o'z ichiga olgan Fe3C+O2→3Fe+CO2 Fe3C+CO2 bilan o'zaro ta'siri natijasida ugleroddagi sirt qatlamining kamayishi. →3Fe+2CO Fe3C+H2O→3Fe+CO + H2. 26 Gaz muhitining tarkibi po'lat va quyma temirning oksidlanish tezligiga kuchli ta'sir ko'rsatadi. Gaz korroziyasida agressiv moddalar, masalan, xlor, oltingugurt birikmalari, kislorod, havo, yod birikmalari va boshqalar bo'lishi mumkin. Ularning turli metallarga nisbatan agressivligi bir xil emas, shuning uchun korroziya tezligi o'zgaradi. Shunday qilib, 900 ° C haroratda Fe, Co, Ni oksidlanish tezligi H2O → CO2 → O2 → SO2 tartibida ortadi. Bunda metallar, bu reagentlar atmosferasidagi korroziya tezligiga qarab, ortib boruvchi ketma-ketlikda joylashgan: Ni → Co → Fe. Agar havoda 900 °C da korroziya tezligi 100% deb faraz qilsak, 2% SO2 qo'shilishi bu ko'rsatkichni 118% ga, 5% H2O ni 134% ga, 2% SO2 + 5% H2O ni 276% ga oshiradi. 2.5.2. Yoqilg'i yonish mahsulotlari ta'sirida korroziya Yoqilg'i yonish mahsulotlari (ko'mir, mazut va boshqalar) ko'p hollarda kuchli oksidlovchi vosita bo'lgan V2O5 shaklidagi oltingugurt birikmalari (SO2, H2S) va vanadiyni sezilarli darajada o'z ichiga oladi. Past eriydigan vanadiy oksidi metall yuzasida shkalaning himoya qatlami bilan o'zaro ta'sir qiladi, uni yo'q qiladi va vanadiy oksidi V2O5 bilan past erish nuqtasi Fe2O3 + V2O5 → 2FeVO4 bo'lgan evtektika11 hosil qiluvchi vanadatlar hosil qiladi. Shunday qilib, temir vanadati (FeVO4) erish nuqtasi = 840 ° C ga ega va V2O5 bilan evtektikasining erish nuqtasi 625 ° C; CrVO4 xrom vanadatining erish nuqtasi 810 °C, V2O5 bilan evtektikasi esa 665 °C. Keyin vanadat metallning o'zi 6FeVO4+4Fe→ 5Fe2O3 + 3V2O3 4Fe+ 3V2O5→ 2Fe2O3 + 3V2O3 V2O3+O2→ V2O5 oksidlanish jarayonida faol ishtirok etadi va V2O5 ning o'zi amalda iste'mol qilinmaydi. Vanadiy korroziyasi eng katta darajada 620 - 700 ° S harorat oralig'ida ishlaydigan o'choq rulolari, tayanchlari va bo'linmalariga ta'sir qiladi. Evtektik (yunoncha éutektos - oson erish), qattiq fazalar bilan ma'lum bir bosimda muvozanatda bo'lgan suyuqlik tizimi (eritma yoki eritma), ularning soni tizimning tarkibiy qismlari soniga teng. 11 27 Shu bilan birga, yuqori haroratli vodorod sulfidli korroziyaga moyil bo'lmagan hatto xrom va xrom-nikel po'latlarining korroziya tezligi yiliga 15 mm ga etadi. Oltingugurt birikmalarining ta'siri ostida temir-uglerodli po'latlar oksidlarga qaraganda sulfidlarning kristall panjaralarida ko'proq nuqsonlar mavjudligi sababli kuchli intergranular korroziyaga uchraydi. Bu diffuziya jarayonlarining kuchayishiga olib keladi. Yonish mahsulotlarida uglerod oksidi (II) miqdori ortishi bilan uglerodli va past qotishma po'latlarning gaz korroziyasi tezligi sezilarli darajada kamayadi. Ammo uning juda yuqori konsentratsiyasi sirtning karburizatsiyasiga olib keladi: 3Fe+2CO→Fe3S+CO2. X40N50 tipidagi yuqori qotishma qotishmalari vanadiy korroziyasiga chidamli. Kremniyning po'latga kiritilishi ham po'latning molibden, volfram va vanadiy bilan qotishmasiga ijobiy ta'sir ko'rsatadi, chunki bu qotishma elementlar V2O5 hosil bo'lishiga yordam beradi. Cu asosidagi qotishmalar bunday korroziyaga juda sezgir. Vanadiy korroziya tezligini kamaytirish uchun hozirda quyidagilar qo'llaniladi: − ish haroratini 650 ° C gacha cheklash; − X40N50 tipidagi qotishmalardan ushbu turdagi vayron bo'ladigan qismlarni ishlab chiqarish uchun foydalanish; − magniy va alyuminiy oksidlarini o'z ichiga olgan vanadiy oksidi bilan o'tga chidamli birikmalar hosil qiluvchi dolomit changini yoqilg'iga puflash; - yoqilg'i tarkibidagi natriy va vanadiyning umumiy miqdorini 2 10-4% dan ko'p bo'lmagan miqdorda cheklash. 2.5.3. Xlor va vodorod xlorid muhitida korroziya Gazsimon xlor va vodorod xlorid muhitida metallarning harakati boshqa agressiv muhitlarning ta'siridan tubdan farq qiladi. Buning sababi shundaki, metall yuzasida hosil bo'lgan xlorid tuzlari past erish nuqtasiga ega va ba'zi hollarda harorat ko'tarilganda ular sublimatsiyalanadi13, masalan, Ti + 2Cl2 → TiCl4. Rag'batlantirish - (sinonimlar) haydash, targ'ib qilish, yo'naltirish. Sublimatsiya - moddaning suyuqlik fazasini chetlab o'tib, qattiq holatdan gazsimon holatga o'tishi; sublimatsiya bilan bir xil. 12 13 28 Bu reaksiyalarning aksariyati ekzotermikdir. Issiqlikni yo'qotish tezligi reaktsiya tezligidan pastroq bo'lib chiqadi, buning natijasida metallar xlor atmosferasida yonadi va "yonib ketadi". Bu haroratning sezilarli mahalliy o'sishiga olib keladi va natijada xloridlar eriydi va parchalanadi. Xlorga eng chidamli nikel, qo'rg'oshin va xrom po'latdir. Quruq xlor atmosferasida ba'zi metallarning yonish harorati: o t yonishi. Ti bilan< 20 Pb 90−100 Fe 150 Cu 200 Ni > 500. Quruq vodorod xloridda xona haroratida bir qator metallar va qotishmalar qoniqarli qarshilikka ega. Haroratning oshishi bilan metall materiallarning qarshiligi asta-sekin har bir metallga xos bo'lgan haroratgacha kamayadi. Quruq xlor va vodorod xloriddagi metallar va qotishmalarning uzoq muddatli ishlashida ruxsat etilgan maksimal yuqori haroratlar jadvalda keltirilgan. 2. Asil metallardan tashqari quruq xlordagi eng chidamli metallar nikel va uning qotishmalaridir. Nikel va xrom-nikel po'latlarida hosil bo'lgan sirt plyonkalari past uchuvchanlik va qoniqarli himoya xususiyatlariga ega. 2-jadval Vodorod xlorid va xlor atmosferasida ba'zi metallar va qotishmalarni ishlatishda ruxsat etilgan haroratlar3] T, °C Materiallar Cl2 1200 − − 550 − 100 150 300 − Platinum Gold volfram Nikel Inconel (80% Cr, 6% Fe) Mis Karbonli po'lat St.Z Zanglamaydigan po'lat 12X18N9T Kumush 29 HCl 1200 870 600 510−600 480 100−120 260−350 450−500 230 2.5.4. Po'latning vodorod korroziyasi Vodorod korroziyasi vodorod o'z ichiga olgan muhitda 200 ° C dan yuqori haroratda va 300 MPa bosimda sodir bo'ladigan ko'plab texnologik jarayonlarga hamroh bo'lishi mumkin. Bu sharoitlar ko'mir va neftni gidrogenlash, ammiak va metanol sintezi va boshqalar kabi jarayonlarga to'g'ri keladi. Vodorod bilan metallarning ikki xil shikastlanishi kuzatiladi - VODOD MO'RTLIKSIZ va VODOD KOROZIYASI. Ko'pincha bu hodisalar bir-birining ustiga chiqadi. Agar gazda ammiak bo'lsa, u holda METALNING NITRIDLANISHI ham sodir bo'lishi mumkin. Azot-vodorod aralashmasi yuqori harorat va bosim sharoitida metall bilan aloqa qilganda, molekulyar vodorod metall yuzasida dissotsiatsiyalanadi. Olingan atom vodorod metall panjara ichiga tarqaladi va unda eriydi. Eruvchanligining pasayishi tufayli harorat pasayganda, vodorod metall ichidagi gaz holatiga o'tishga intiladi. Bunday holda, metallda katta stresslar paydo bo'lib, qaytarilmas mo'rtlikka olib keladi. Vodorod korroziyasi vodorodning po'latning karbid komponenti bilan kimyoviy o'zaro ta'siri natijasidir. Tashqi tomondan, vodorod korroziyasining namoyon bo'lishi sirtni sezilarli darajada yo'q qilmasdan po'latning mustahkamligining kuchli pasayishini anglatadi. Vodorod korroziyasining mexanizmi quyidagi bosqichlarni o'z ichiga oladi: - yuqori haroratda molekulyar vodorod po'lat yuzasi tomonidan so'rilgan va uning kristall panjarasiga tarqaladigan atomlarga ajraladi; - faol qaytaruvchi vosita bo'lgan atom vodorod temir karbidini kamaytiradi va po'latda erigan uglerod bilan qaytarilmas reaktsiyalar orqali o'zaro ta'sir qiladi: Fe3C + 2H2 3Fe + CH4 C + 4H CH4, shuning uchun po'latni mustahkamlovchi asosdan mahrum qiladi. Diffuziya jarayonlari, shu jumladan vodorod harakati, sementit plitalari asosan joylashgan don chegaralari bo'ylab osonlik bilan amalga oshirilganligi sababli, ularning vodorod bilan yo'q qilinishi kristallitlar orasidagi aloqaning buzilishiga va shunga mos ravishda po'latning egiluvchanligining pasayishiga olib keladi. . 30 Olingan metan ferrit kristall panjarasining parametrlariga nisbatan katta molekulyar hajmga ega. Natijada, u metallning asosiy qismidan tarqala olmaydi va uning mikro bo'shliqlari va nuqsonlarida to'planib, yuqori bo'shliq ichidagi bosimni keltirib chiqaradi va yorilishga olib keladi. Bunday holda, yoriqlar don chegaralari bo'ylab rivojlanadi. Kuchliligi past bo'lgan yumshoq po'latlarda metan to'planishi asosan sirtga yaqin qatlamda sodir bo'lib, po'lat yuzasida aniq ko'rinadigan shishlar hosil qiladi. Metan hosil bo'lishida ishtirok etishdan tashqari, vodorod metallda yaxshi eruvchanlikka ega. Metallda erigan vodorodning konsentratsiyasi vodorodning metall-gaz chegarasidagi parsial bosimiga bog‘liq bo‘lib, quyidagi formula bilan aniqlanishi mumkin: = Ks p1/2, bu yerda – po‘latdagi erigan vodorod miqdori, sm3/. 100 g; p – vodorodning qisman bosimi, at; Ks - vodorodning po'latdagi eruvchanligi p = 1 da. Vodorodning metall tomonidan erishi endotermik jarayon bo'lgani uchun vodorodning eruvchanligi harorat oshishi bilan ortadi. Bu hodisa VODOD O'TGIRGANLIGI (VH) 4] deb ataladi. Po'latning vodorod o'tkazuvchanligi undagi uglerod va qotishma elementlarning tarkibiga bog'liq va uglerod miqdori ortishi bilan kamayadi, bu jadvalda keltirilgan ma'lumotlardan dalolat beradi. 3. 3-jadval Uglerodli po'latlarning vodorod o'tkazuvchanligiga uglerod miqdorining ta'siri Metall C, og'irligi% VN, sm3/sm2h mm–1 Texnik temir 0,04 5,10 Po'lat 15 0,15 4,09 Chelik 30 0,27 2,79 Chelik U1042 korroziya ko'rinmaydi. po'lat vodorodga duchor bo'lgan paytdan boshlab darhol, lekin ma'lum vaqtdan keyin. Po'latning mikro tuzilishi va mexanik xususiyatlarida hech qanday o'zgarishlar bo'lmagan bu vaqt PO'latni DEKARBARLASH JARAYONINING INKUBATSIYA DAVRI deb ataladi. 31 Kuluçka davri katta amaliy ahamiyatga ega, chunki u asosan uskunaning xavfsiz ishlash vaqtini belgilaydi. Kuluçka muddati asosan harorat va bosimga bog'liq. Harorat va bosimning oshishi bilan inkubatsiya davri kamayadi. Shu bilan birga, inkubatsiya davrining davomiyligi po'latning kimyoviy tarkibiga katta ta'sir ko'rsatadi. Vodorodning harorati va qisman bosimi nafaqat inkubatsiya davrining davomiyligiga, balki vodorod korroziyasi paytida po'latning dekarburizatsiya tezligiga ham ta'sir qiladi. 2.5.5. Karbonil korroziyasi Karbonil korroziyasi yuqori bosim va haroratda uglerod ishtirokidagi texnologik jarayonlarda sodir bo'ladi. Bunday jarayonlarga, masalan, metil va butil spirtlarini ishlab chiqarish, metan va uglerod oksidini aylantirish kiradi. Oddiy sharoitlarda CO metallarga nisbatan inertdir. Yuqori harorat va bosimlarda uglerod oksidi ko'plab metallar bilan reaksiyaga kirishib, karbonillarni hosil qiladi. Masalan, Fe + nCO = Fe (CO) n. Temir va CO uchta birikma hosil qilishi mumkin: tetrakarbonil - Fe (CO) 4, pentakarbonil - Fe (CO) 5 va nanokarbonil - Fe (CO) g. Bu birikmalarning barchasi juda beqaror va harorat ko'tarilganda parchalanadi. Ular orasida eng barqaror birikma Fe(CO)5 dir. Karbonillarning hosil bo'lishi harorat 100 ºS dan oshishi bilan kuchayadi, keyin 140 - 180 ºS harorat oralig'ida ularning Fe va CO ga deyarli to'liq ajralishi kuzatiladi. Uglerod oksidi (II) ko'plab boshqa metallar bilan o'xshash birikmalar hosil qilishi mumkin. Karbonil korroziyasi 5 mm chuqurlikdagi metallning sirt qatlamini yo'q qilish va bo'shashishiga olib keladi. Sirtdan kattaroq masofada metallning tuzilishidagi o'zgarishlar endi sodir bo'lmaydi. 2.5.6. Elektrolit bo'lmaganlarda korroziya NOELEKTROLITLAR - elektr tokini o'tkazmaydigan suyuqliklar. Noorganik kelib chiqadigan suyuq korroziv muhitlar - suyuq brom, erigan oltingugurt va boshqalar Suyuq organik moddalar - benzol, xloroform va boshqalar, suyuq yoqilg'i (neft, kerosin, benzin va boshqalar), moylash moylari. Sof shaklda ular past agressivdir, ammo ularda hatto kichik miqdordagi aralashmalar (merkaptanlar14, vodorod sulfidi, suv, kislorod va boshqalar) mavjudligi ularning kimyoviy faolligini keskin oshiradi. Shunday qilib, xom neft tarkibidagi merkaptanlar va vodorod sulfidi mos ravishda Fe, Cu, Ni, Ag, Pb, Sn korroziyasiga olib keladi, ularning merkaptidlari (Me−(S−R)n) va polisulfidlari (Me2Sx) hosil bo'ladi. Uglerod tetraklorididagi suv izlari gidroliz natijasida o'tkazuvchan komponentlar (HCl) hosil bo'lishi va elektrokimyoviy mexanizm bilan korroziyaning paydo bo'lishi tufayli uning korrozivligini oshiradi: CCl4 + H2O → COCl2 + 2HCl CCl4 + 2H2O + kat → CO2 + Asosan noelektrolitlardagi metallarning korroziyasi kimyoviy mexanizm orqali boradi. Bu jarayon bir necha bosqichlardan iborat bo'lib, ularning har biri korroziya tezligini belgilaydi: 1) oksidlovchining metall yuzasiga tarqalishi; 2) oksidlovchi moddaning xemisorbsiyasi; 3) kimyoviy reaksiya; 4) korroziya mahsulotlarini metall yuzasidan desorbsiyalash; 5) korroziya mahsulotlarining elektrolit bo'lmagan hajmiga tarqalishi. Ba'zi hollarda korroziya mahsulotlaridan metall yuzasida himoya plyonka hosil bo'ladi, bu oksidlovchining metall yuzasiga tarqalishi qiyinligi tufayli korroziya jarayonining inhibisyoniga olib keladi. Olingan plyonkaning himoya xususiyatlariga va uning eruvchanligiga qarab, jarayonning diffuziya, kinetik yoki aralash diffuziya-kinetik nazorati o'rnatilishi mumkin. Harorat elektrolitlar bo'lmagan metallarning kimyoviy korroziya tezligiga sezilarli darajada ta'sir qiladi (2.4. bo'limga qarang). Haroratning jarayon tezligiga ta'siri ba'zi hollarda harorat o'zgarganda oksidlovchining eruvchanligi va elektrolit bo'lmaganda metall korroziya mahsulotlari plyonkasi o'zgarishi bilan murakkablashadi. 14 Merkaptanlar uglevodorodlarning gidrosulfid hosilalari: R – S –H. 33 Noelektrolitlarda suvning mavjudligi aralashmalarning korroziy ta'sirini sezilarli darajada faollashtiradi va metallarning kuchli elektrokimyoviy korroziyasini keltirib chiqaradi, ya'ni. korroziya jarayonining mexanizmi o'zgaradi. Elektrolit bo'lmagan metallarni kimyoviy korroziyadan himoya qilish uchun ma'lum bir muhitda barqaror bo'lgan metallar va qotishmalar tanlanadi (masalan, alyuminiy va uning qotishmalari yorilgan benzinda barqaror) va himoya qoplamalar qo'llaniladi (masalan, po'lat vodorod sulfidi muhiti alyuminiy bilan qoplangan). 2.6. Metalllarni har xil turdagi gaz korroziyasidan himoya qilish usullari 2.6.1. Po'latni gaz korroziyasidan himoya qilish usullari Po'latni gaz korroziyasidan himoya qilish uchun issiqlikka chidamli ALOYING va HIMOYA QO'PLAMALARI eng ko'p qo'llaniladi. Qotishma - (nem. legieren - "birlashtirmoq", lotincha ligare - "bog'lash") - asosiy materialning fizik va / yoki kimyoviy xususiyatlarini o'zgartirish (yaxshilash) uchun materiallar tarkibiga aralashmalar qo'shish. Metalllarni yuqori haroratlarda oksidlanishdan himoya qilishning asosiy usullari QAYTALASHGA asoslangan. Yuqori haroratlarda oksidlangan metallarning qarshiligi metallni qoplaydigan oksid plyonkasining himoya xususiyatlariga bog'liq. Temir-uglerod qotishmalarida himoya qatlamini yaratishga hissa qo'shadigan elementlar xrom, alyuminiy va kremniydir. Bu elementlar havoda yuqori haroratda qotishma metallga qaraganda osonroq oksidlanadi va barqarorroq shkala hosil qiladi. Issiqlikka chidamli qotishma nazariyasiga ko'ra, qotishma komponent metall yuzasida faqat qotishma komponentining oksididan iborat bo'lgan himoya qatlamini hosil qiladi. Qotishtiruvchi element quyidagi asosiy talablarni qondirishi kerak: Metall yuzasida hosil bo'lgan oksid doimiy bo'lishi kerak, ya'ni. Vok/VMe nisbati >1 bo'lishi kerak. Oksid qatlami yuqori ohmik qarshilikka ega bo'lishi kerak rMeO > rFe, qotishma komponent ionlarining o'lchami asosiy metall ionlarining o'lchamidan kichikroq bo'lishi kerak, ya'ni. rMe< rFe. Это условие вытекает из следующих соображений: 34 а) меньший радиус иона легирующего компонента по сравнению с ионом основного металла позволяет предполагать у легирующего компонента больший коэффициент диффузии в сплаве, что может обеспечить преимущественный выход ионов компонента на поверхность сплава и, следовательно, преимущественное образование оксида легирующего компонента; б) меньший радиус иона легирующего компонента позволит образовать оксид с соответствующими меньшими параметрами, который будет оказывать большое сопротивление диффузии через него и, следовательно, создавать большое затруднение для окисления основного металла. Это подтверждается сравнением размеров ионных радиусов железа и легирующих элементов: хрома, алюминия и кремния Ион металла Ионный радиус, Аº Fe2+ 0,74 Cr6+ 0,52 Al3+ 0,50 Si4+ 0,41. А энергия образования оксида легирующего компонента должна быть больше энергии образования оксида основного металла ΔGMeO<ΔGFeO. Если это условие не соблюдается, то оксид легирующего компонента будет восстанавливаться основным компонентом, как например, оксидная пленка меди, которая не может быть устойчивой на железном сплаве вследствие возможности протекания реакции CuO+Fe → FeO+Cu. При этом необходимо соблюдение условий: высокая температура плавления оксида легирующего компонента, низкая упругость диссоциации, а также отсутствие низкоплавких эвтектик в смеси с другими оксидами для того, чтобы оксид легирующего компонента был достаточно устойчив. В качестве примера можно привести элемент бор, который является аналогом Al по таблице Менделеева, но дает легкоплавкие оксиды. Температура плавления ВО3 − 294 0С, и поэтому бор, в отличие от алюминия, не может быть легирующим компонентом, повышающим жаростойкость. Необходимым условием является также, образование твердых растворов между легирующими компонентами и основным металлом, так как при этом условии возможно равномерное распределение этого элемента на поверхности и образование сплошной пленки оксида легирующего компонента. 35 Существует и другая теория, согласно которой легирующий элемент образует на поверхности сплава смешанные оксиды, обладающие повышенными защитными свойствами, по сравнению с оксидами чистых компонентов. Механизм повышения жаростойкости можно свести к тому, что легирующий компонент должен уменьшить возможность образования в окалине вюститной фазы (FeO) на стали и, таким образом, благоприятствовать образованию шпинельной фазы типа Fe3O4ּγFe2O3 с возможно меньшим параметром решетки. Жаростойкие легированные стали имеют на поверхности оксидные слои со структурой именно шпинели. Еще более высокими защитными свойствами обладают сложные шпинели типа FeOּMe2O3 или Fe2O3 ּMeO. С целью экономии легированных сталей жаростойкость углеродистых сталей повышают, применяя защитные покрытия. Для нанесения на сталь защитных покрытий пользуются следующими методами: ТЕРМОДИФФУЗИОННЫМ, НАПЛАВКОЙ И ПЛАКИРОВАНИЕМ. Для нанесения покрытий термодиффузионным методом стальное изделие после очистки поверхности механическим способом и травлением помещают в реакционную смесь, состоящую из порошка наносимого металла и катализатора. Например, при нанесении алюминиевых покрытий смесь содержит измельченный ферроалюминиевый и хлористый аммоний. Процесс насыщения поверхности стали алюминием (АЛИТИРОВАНИЕ) производится при высоких температурах (900−9500С), в результате чего происходит разложение хлористого аммония на аммиак и хлористый водород: NH4Cl → NH3 + HCl, который, в свою очередь, взаимодействует с алюминием 2Al +6HCl → 3H2 + 2AlCl3. На поверхности стального изделия происходит выделение атомарного алюминия AlCl3 +Fe → FeCl3 + Al, который диффундирует в сталь. Значительное повышение жаростойкости стали термодиффузионным покрытием обусловлено образованием окислов Al2O3 или двойных окислов FeAl2O4 в алитированном слое. На поверхности хромированных или силицированных изделий образуются соответствующие оксиды хрома или кремния. 36 НАПЛАВКА − это нанесение слоя металла или сплава на поверх- ность изделия посредством сварки плавлением. ПЛАКИРОВА́НИЕ − (фр. plaquer − накладывать, покрывать) термомеханическое покрытие − нанесение на поверхность металлических листов, плит, проволоки, труб тонкого слоя другого металла или сплава термомеханическим способом. Для защиты от карбонильной коррозии применяют хромистые стали с содержанием 30 % Сг, хромоникелевые стали с содержанием 23 % Сг и 20 % № и марганцевые бронзы доя работы при температуре до 700 °С и давлении до 35 МПа. При более низких параметрах возможно применение менее легированных сталей типа Х18Н9. Сырьем для синтеза мочевины CO(NH2)2 является NH3 и СО2. Процесс протекает при температуре 175−190°С и давлении 20 МПа. Хромистые нержавеющие стали различных марок непригодны для изготовления основных аппаратов. Наибольшую стойкость имеют стали, легированные молибденом, и хромникельмолибденовомедные стали. Важным фактором для повышения коррозионной устойчивости является тщательная очистка газов от сероводорода и дополнительное введение в систему кислорода в количестве 0,5- 1,0 об.% от содержания СО2. При сернистой коррозии сера и ее соединения - сернистый ангидрид (SO2), сероводород (H2S), меркаптаны или тиоспирты и т.д. являются достаточно агрессивными, коррозионно−активными веществами. Наиболее активным компонентом при высокотемпературной газовой коррозии является сероводород. Он даже более опасен, чем диоксид серы. Сернистый газ SO2 является исходным продуктом при производстве серной кислоты. Его получают при обжиге серного колчедана, сжигании серы, из сероводорода при утилизации отходящих газов металлургических производств. Чугунные детали скребков конверторных печей кипящего слоя, зубья и гребки колчеданных печей, котлы−утилизаторы, сухие электрофильтры, газоходы обжиговых газов в производстве серной кислоты часто выходят из строя вследствие газовой коррозии. В результате коррозии черных металлов в сернистом газе при температурах 300°С и выше образуется слоистая окалина, состоящая из FeS, FeO и др. 37 При температуре газа более 400 °С для деталей из чугуна характерно увеличение объема металла, достигающего 10 % от начальной величины. При этом резко снижается прочность материала. Детали испытывают коробление, трескаются и разрушаются. Это явление называется «ростом» чугуна и объясняется внутренним окислением металла. Максимальный рост чугуна наблюдается при 700 °С. К ростоустойчивым чугунам относятся высоколегированные хромистые чугуны, карбидный чугун типа «пирофераль» и «чугаль» Сернистый газ при высоких температурах окисляет никель. При этом образуется окалина, в состав которой входят NiS и NiO: 3Ni + S02 = NiS + 2NiO. Сернистый никель образуется и при действии на металл сероводорода: Ni + H2S = NiS + Н2. Сульфид никеля с металлическим никелем образует легкоплавкую эвтектику с температурой плавления около 625 °С. Образование этой эвтектики в сталях, содержащих никель, происходит преимущественно по границам зерен, вызывая разрушение металла. Стали с содержанием никеля выше 15 % очень чувствительны к действию сернистого газа. В процессе окисления они теряют механическую прочность. Поэтому при работе с газовой средой, содержащей диоксид серы, при температурах до 400 °С используют углеродистые стали, а при более высоких температурах − хромистые стали. Наиболее употребительны жаростойкие стали − 4Х9СА, Х6СЮ, XI7, ОХ 17 Г, X1800, Х25Т. Интенсивное образование окалины происходит при температурах выше 800−1000 °С. К жаропрочным сталям в этой среде относятся Х5М, Х6СМ, XI8Н12Т, Х23Н18. Рабочая температура для этих сплавов 550−600 °С (для Х23Н18 − 1000 °С). Сухой сернистый газ реагирует с алюминием очень медленно. Поэтому алюминий используют для защиты от коррозии деталей и узлов теплообменников и контактных аппаратов. Сухой сероводород при комнатной температуре не представляет опасности для обычных углеродистых сталей. С повышением температуры опасность сероводородной коррозии углеродистых сталей значительно увеличивается. При температуре выше 300 °С 38 железо подвергается сильной коррозии в серосодержащих газовых средах. Легирование хромом в количестве > 12% 700-800 ° S gacha bo'lgan haroratlarda korroziyaga chidamliligini oshiradi. Xromli po'latlar korroziyaga uchraganda, shkala hosil bo'ladi, uning tashqi qatlami temir sulfiddan iborat. Bu qatlamda xrom deyarli yo'q. Barcha oksidlangan xrom ichki qatlamda to'plangan bo'lib, u himoya xususiyatiga ega. Ferritik rasm 5 10 15 20 oltingugurt-Cr, og'irligi% vodorod atmosferasida yaxshi kimyoviy qarshilikka ega. 6. 650 ° S da yog 'bug'ida 25-30% qattiq po'latdan iborat bo'lgan xrom qotishmalarining korroziya darajasi. Egri chiziqlardagi raqamlar xromni ko'rsatadi. H2S tarkibi, % Ayniqsa xavfli oltingugurt birikmalari va boshqa korroziv komponentlarning birgalikda mavjudligi. Shunday qilib, neft sanoatida oltingugurtli moylarni termik qayta ishlash jarayonida vodorod sulfidi va vodorod aralashmasi alohida xavf tug'diradi. Shaklda ko'rsatilganlardan. 6 ma'lumotlari shuni ko'rsatadiki, xromli po'latlarning korroziya tezligi neft bug'ida vodorod sulfidining kontsentratsiyasi ortishi bilan ortadi. Bunday holda, H2S kontsentratsiyasining 10 barobar ortishi korroziya tezligini 12-15 martadan ko'proq oshirishga olib keladi. Yoqilg'i yoqilganda, tarkibida O2 va turli oksidlar, shu jumladan oltingugurt aralashmalari bo'lgan murakkab gaz aralashmalari hosil bo'ladi. Bunday hollarda SULFID-OKSID korroziyasi kuzatiladi. Metall ustidagi himoya plyonkasi odatda bir necha qatlamlardan iborat. Tashqi qatlam kislorod bilan boyitilgan va metall oksididan iborat bo'lib, metall yuzasiga ulashgan ichki qatlamlarda ko'p miqdorda oltingugurt va sulfidlar mavjud. Agar yoqilg'ining yonishi vanadiy oksidi V2O5 o'z ichiga olgan kul hosil qilsa, u holda korroziya tezligi juda tez ortadi. Po'latlarning vanadiy korroziyasining sabablari avvalroq muhokama qilingan (2.5.2 bo'limga qarang). 39 4−6% Cr ni o'z ichiga olgan xromli po'latlar yarim issiqlikka chidamli hisoblanadi. Ushbu toifadagi po'latlar mavjudligi, korroziyaga chidamliligi va mustahkamligi tufayli neft sanoatida kreking agregatlarini ishlab chiqarish uchun keng qo'llaniladi. Ushbu po'latlarning havoda va 500-600 ºS haroratda oltingugurt birikmalarining katta miqdori bo'lgan tutun gazlarida issiqlikka chidamliligi qotishmagan po'latlarning issiqlikka chidamliligidan taxminan 3 baravar yuqori. 2.6.2. Vodorod korroziyasidan himoya qilish usullari Po'latlarning vodorodga chidamliligini oshirishning asosiy usullaridan biri ularni sementitga qaraganda barqarorroq karbidlar hosil qiluvchi kuchli karbid hosil qiluvchi elementlar bilan QUYTISHdir. Bunday elementlar xrom, volfram, molibden, vanadiy, niobiy, titandir. Karbid fazasining turi po'latning vodorod qarshiligiga katta ta'sir ko'rsatadi. Xrom bilan qotishma po'latlarda vodorod qarshiligi quyidagi qatordagi karbid fazasining tarkibiga qarab kamayadi: (Cr,Fe)23C6(Cr,Fe)23C6 + (Cr,Fe)7C3(Cr,Fe) 7C3 (Cr,Fe)7C3 + (Fe,Cr)3C(Fe,Cr)3C Yuqoridagi qatorlar xromli po’latlarda eng katta vodorod qarshiligiga (Cr,Fe) karbidlari hosil bo’lishi bilan erishilishini ko’rsatadi. )23C6 turi. Po'latdagi uglerod miqdori 0,05% bo'lgan ushbu turdagi karbidning hosil bo'lishi po'latda kamida 6% xrom mavjud bo'lganda sodir bo'ladi va uglerod miqdori ortishi bilan xrom miqdorini oshirish kerak bo'ladi. Xromga qaraganda kuchliroq karbid hosil qiluvchi elementlar bilan po'latni qotishganda, bu elementlar barcha uglerodni MeC tipidagi karbidlarga bog'lash uchun etarli miqdorda bo'lganda, po'latning eng katta vodorod qarshiligiga erishiladi. Uskunalar elementlari yuqori darajadagi mexanik yuklar sharoitida ishlaydigan hollarda, vodorodga chidamli po'latlar ham issiqlikka chidamli bo'lishi kerak. Ushbu shartlar uchun 3% Cr bo'lgan, qo'shimcha ravishda Mo, V yoki W bilan qotishma qilingan po'latlar, masalan, 20X3MVF (EI579) po'lat navi ishlatiladi. X5M, X5VF, X9M, 1X13 po'lat navlari yanada katta qarshilikka ega. Eng og'ir sharoitlarda austetik issiqlikka chidamli xrom-nikel po'latlari 0X18N10T yoki X17N17M2T ishlatiladi. 40 Po'latlarning vodorodga chidamliligini oshirishning yana bir keng qo'llaniladigan usuli ularni vodorod o'tkazuvchanligi asosiy metallga qaraganda pastroq bo'lgan metallar bilan QAPLASHdir. Bu asosiy metall va qoplama qatlami orasidagi interfeysda vodorod kontsentratsiyasini kamaytirishga va uning asosiy metallga agressiv ta'sirini kamaytirishga imkon beradi. Asos va qoplama metalli interfeysidagi samarali vodorod bosimini hisoblash quyidagi tenglama bo'yicha amalga oshiriladi: 1/2 1/2 p2 = p1 (11) + bu erda p1 - vodorodning tashqi yuzasidagi bosimi. qoplama qatlami; p2 - qoplama va asosiy metall interfeysidagi samarali vodorod bosimi; = VN1/VN2 - mos ravishda qoplama qatlami va asosiy metallning vodorod o'tkazuvchanligi nisbati; = l1 / l2 - mos ravishda qoplama qatlami va asosiy metall qalinligining nisbati. Vodorod o'tkazuvchanligini oshirish uchun metallar va qotishmalarni ketma-ket joylashtirish mumkin: alyuminiy, mis, nikel, X18N10T, 0X13. Amalda kimyo va neftni qayta ishlash sanoatida asosan uglerodli yoki 0X13 yoki X18N10T po'latlarning himoya qatlami bo'lgan kam qotishma po'latlardan tayyorlangan bimetallardan foydalaniladi. Tanlangan po'latdan yasalgan uskunaning ish harorati vodorod korroziyasi mumkin bo'lgan haroratdan 25 ° C past bo'lishi kerak. 3-bob. METALLARNING ELEKTROKIMYOVIY KOROZİYASI 3.1. Metalllarning elektrod potentsiallari Metallni elektrolitga botirganda, 5, 6 qo'sh elektr qavat hosil bo'lishi sababli fazalar chegarasida potensial sakrash sodir bo'ladi. Agar metall plastinka, masalan, mis plastinka suvga yoki mis tuzi eritmasiga botirilsa, u holda musbat zaryadlangan Cu2+ ionlari suv bilan chegarada joylashgan metall qatlamdan suvga o'ta boshlaydi. Bunday holda, metallning kristall panjarasida ortiqcha elektronlar paydo bo'ladi va plastinka manfiy zaryad oladi. Salbiy zaryadlangan plastinka va eritma ichiga o'tgan musbat ionlar o'rtasida elektrostatik tortishish paydo bo'ladi, bu esa mis ionlarining eritmaga keyingi o'tishini oldini oladi, ya'ni metallni eritish jarayoni to'xtaydi. Shu bilan birga, teskari jarayon rivojlanadi: eritmadan mis ionlari plastinka yuzasiga yaqinlashib, undan elektronlarni qabul qiladi va neytral holatga o'tadi. Muayyan vaqtdan so'ng, dinamik muvozanat holati o'rnatiladi, bunda ionlarning metalldan eritmaga o'tish tezligi eritmadan ionlarning metallga tushish tezligiga teng bo'ladi. Ta'riflangan hodisa sxematik tarzda rasmda ko'rsatilgan. 7 (oddiylik uchun metall ionlari hidratlanmagan holda ko'rsatilgan). Ko'rib chiqilayotgan misol uchun eritmadagi ionlar va metall o'rtasidagi muvozanat tenglama bilan ifodalanadi: Cu2+r−r + 2ē Cuºkristal Elektrokimyoviy reaksiyaning muvozanat tenglamasida elektronlar odatda chap tomonda yoziladi. ya'ni qisqartirish jarayoni yoziladi. 7-rasm. Metall-eritma interfeysida qo'sh elektr qatlamning paydo bo'lish sxemasi Yuqoridagi misoldan ko'rinib turibdiki, metall uning tuzi eritmasi bilan aloqa qilganda, ikkita aloqa fazasi qarama-qarshi zaryadlarni oladi. Natijada, fazalar interfeysida qo'sh elektr qatlam hosil bo'ladi va metall va eritma o'rtasida potentsial sakrash () sodir bo'ladi. Agar eritma ichiga turli metallardan iborat ikkita metall plastinka (M1 va M11) tushirilsa, galvanik juftlik paydo bo'ladi, unda faolligi kamroq bo'lgan metall kamayadi va faolroq bo'lgan metall oksidlanadi (8-rasm). Guruch. 8. Galvanik elementning ishlash sxemasi Umuman olganda, bu galvanik juftning ishi potentsiallar farqi (galvanik elementning emf) bilan aniqlanadi va yarim reaksiyalar muvozanati bilan birga keladi: E = ox - qizil, bu yerda ox - oksidlovchining potensiali, V; qizil – qaytaruvchi agent potensiali, V. Men+(ox) + ne ⇆ Meº Meº(qizil) − ne ⇄ Men+. Vaqt birligida eritmaga o'tadigan kationlar soni metall yuzasida to'plangan kationlar soniga teng bo'lganda, dinamik muvozanat yuzaga keladi va erish jarayoni to'xtaydi. Shuning uchun bunday sharoitda ko'p miqdordagi metall ionlari atomlarining eritmaga o'tishi mumkin emas. Biroq, agar elektr qo'sh qavatning muvozanati elektronlarni zaryadsizlantirish yoki metall ion atomlarini olib tashlash orqali buzilgan bo'lsa, korroziya jarayoni to'sqinliksiz davom etadi. O'z ionlari bilan muvozanatda bo'lgan metallarning elektrod potensiallari muvozanat deyiladi. Muvozanat potentsialining qiymatini Nernst tenglamasi yordamida har qanday ion faolligi uchun hisoblash mumkin: E = Eº + (RT /nF)ln(aMen+), (12) n+ bu yerda Eº aMe = 1 da standart potensiallar farqi; R – universal gaz doimiysi, 8,3 kJ/kmolK; T – mutlaq harorat, ºK; n – metallning valentligi; F – Faraday raqami 96500 S/mol; 43 aMen+ – mol/l dagi metall ionlarining faolligi. Agar barcha konstantalarni 25°C da (T = 298 K) almashtirsak va natural logarifmlardan o‘nlik sonlarga o‘tish uchun 2,3 ga ko‘paytirsak, quyidagi ifodani olamiz E = Eº + (0,0592/n)log(aMen+), ( 13) Eritma suyultirilganda metallning potensiali manfiy tomonga siljiydi. Agar, masalan, rux tuzi eritmasidagi Zn2+ ionlarining faolligi 10–2 mol/l bo‘lsa, bu eritmaga botirilgan ruxning muvozanat potensiali quyidagilarga teng bo‘ladi: E = - 0,76 + (0,0592/2) lg10−2 = - 0,819 V, (14) Eritmadagi metall ionlari konsentratsiyasi ortishi bilan metall potensiali, aksincha, ijobiy tomonga siljiydi. Shunday qilib, agar rux ionlarining faolligi 10 mol/l sifatida qabul qilinsa, u holda ruxning potensiali E = - 0,76 + (0,0592/2)log10 = - 0,73 V, (15) metallarning elektrod potentsiallari bo'ladi. potentsialni belgilaydigan almashinuv jarayoni nafaqat o'z, balki boshqa ionlar va atomlarni ham o'z ichiga oladi, ular muvozanatsiz yoki qaytarilmas deb ataladi. Muvozanatsiz potentsiallar uchun Nernst formulasi qo'llanilmaydi, chunki metallda sodir bo'ladigan reaktsiyalar, ya'ni. elektronlarni yo'qotish va olish turli yo'llar bilan sodir bo'ladi va potentsial elektrodda biron bir reaktsiyaning muvozanatining boshlanishini tavsiflay olmaydi. Muvozanatsiz potentsiallarning kattaligiga elektrolitning tabiati, harorati, elektrolit harakati, eritma konsentratsiyasi va boshqalar ta'sir qiladi.Masalan, alyuminiyning 3% NaCl dagi potensiali - 0,6 V, 0,05 M Na2SO4 - 0,47 V, va 0,05 M Na2SO4 + H2S - 0,23 V. Metall yoki elektrolitlar yuzasining elektrokimyoviy heterojenligi tufayli metallda turli xil potentsialga ega bo'lgan joylar hosil bo'ladi. Metall sirtining elektrokimyoviy xilma-xilligini keltirib chiqaradigan asosiy sabablar quyidagilar bo'lishi mumkin: − LIQUATION − (La likuation, Saigerung) - qotishmalarning suyuq holatdan qattiq holatga o'tish jarayonida turli erish nuqtalariga ega bo'lgan komponentlar yoki alohida birikmalarga parchalanish qobiliyati. ; - himoya plyonkasining heterojenligi; 44 - jismoniy sharoitlarning heterojenligi - metallning turli sohalarida teng bo'lmagan harorat, deformatsiyalangan joylar, stress konsentratorlari mavjudligi; − elektrolitlar heterojenligi - kislorod kontsentratsiyasidagi farq yoki tuz konsentratsiyasi, turli pH qiymati. Salbiy potentsialga ega bo'lgan joylar ANODIC deb ataladi, ijobiy potentsial bo'lgan joylar KATOD deb ataladi. Metall sirtining heterojenlik darajasi katod va anodik kesimlarning potentsiallari farqi bilan belgilanadi. 3.2. Elektrokimyoviy korroziyaning termodinamiği Korroziya jarayonining o'z-o'zidan paydo bo'lish imkoniyati erkin energiyaning (izobarik-izotermik potensial) kamayishi bilan aniqlanadi G.< 0: G = −nFE < 0, (16) где n – эквивалентное число электронов; Е = К – А – эдс гальванического элемента, образующегося при контакте металла с окислителем в процессе коррозии; К – обратимый потенциал катодной реакции (окислителя); А – обратимый потенциал анодной реакции (металла – восстановителя); F – число Фарадея. Принципиальная возможность протекания процесса электрохимической коррозии металла имеет место при К > A yoki E > 0. Elektrolitdagi oksidlovchi moddaning qaytariladigan oksidlanish-qaytarilish potentsiali shu sharoitda metallning bir xil sharoitdagi qaytariladigan potentsialidan ko‘ra ijobiyroq bo‘lishi kerak. Metalllarning elektrokimyoviy korroziyasining termodinamik imkoniyati chegaralarini belgilash uchun Pourbaix diagrammalaridan foydalanish mumkin. Diagrammalar teskari elektrod potentsiallarining (vodorod shkalasi bo'yicha voltlarda) muvozanat holatlari uchun eritmaning pH ga bog'liqligining grafik tasvirlari: elektronlar ishtirokida - gorizontal chiziqlar; elektronlar va ionlar ishtirokida H+ yoki OH– - qiya chiziqlar; H+ va OH- ionlari ishtirokida, lekin elektronlar ishtirokisiz (gidrat hosil bo'lishining pH qiymati) - vertikal chiziqlar. 45 9-rasm. Diagramma E - Al-H2O tizimi uchun pH 25 ° C da misol sifatida shakl. 9-rasmda Al - H2O tizimi uchun Pourbaix diagrammasi ko'rsatilgan. Diagrammaning har bir mintaqasi bitta termodinamik barqaror holatga to'g'ri keladi: metall holat, eritmadagi ionlar shaklida, oksidlar yoki gidroksidlar shaklida. Eritmada muvozanatning o'rnatilishi nafaqat vodorod ionlariga, balki boshqa ionlarga ham bog'liq bo'lganligi sababli, hududlarni chegaralash bir nechta muvozanat chiziqlari bilan hosil bo'ladi. Ushbu chiziqlarning har biri tegishli ionlarning o'ziga xos faolligiga mos keladi. Diagrammaning pastki qismidagi mintaqada alyuminiy metall termodinamik jihatdan barqaror va korroziyaga uchramaydi. Gorizontal chiziq ustidagi chap qismda alyuminiyning eritmadagi Al3+ ionlari holati termodinamik jihatdan barqaror. O'rta hudud Al2O3 oksidi yoki Al (OH) 3 gidroksidning qattiq fazalarining barqarorligiga mos keladi, bu korroziya jarayonida alyuminiy yuzasida himoya plyonka hosil qiladi. O'ng tomon alyuminiy eritmada AlO2-anion hosil bo'lishi bilan korroziyaga uchraydigan sharoitlarni tavsiflaydi. 3.3. Elektrokimyoviy korroziyaning mexanizmi Elektrolitlardagi metallarning korroziyasi galvanik juftlarning hosil bo'lishi bilan sodir bo'ladi, ular korroziya juftlari deb ataladi. Agar siz rux va temir xlorid eritmalari solingan idishga (8-rasmdagi pH me diagrammasiga o'xshash) mos ravishda sink va temir plitalarni tushirsangiz va ularni tashqi o'tkazgich bilan ulasangiz, sxemaga ulangan milliampermetr ko'rsatadi. zanjirda elektr tokining mavjudligi. Galvanik juftlik hosil bo'lib, unda sink oksidlanadi va eritma (anod) ga kiradi. Temir oksidlanmaydi va eritmaga kirmaydi, chunki u sink bilan birlashganda katod vazifasini bajaradi. Sink bilan birlashtirilmagan temir shunga o'xshash eritmada korroziyaga uchraydi. Amalda, qotishmalarda ko'p miqdordagi mikroelementlar va bir-biriga o'xshamaydigan metallar mavjud. Boshqacha qilib aytganda, bir-biriga o'xshamaydigan metallar bir-biri bilan va elektrolitlar bilan to'g'ridan-to'g'ri aloqa qilishda bir xil tekislikda joylashgan. Natijada anodlar katodlar bilan almashinadigan ko'p elektrodli hujayra hosil bo'ladi. Anodik joylarda metall ionlari (Men+) eritma ichiga kiradi. Chiqarilgan elektronlar (nē) metall bo'ylab anoddan katodga o'tadi. Metall ionlarining suvli eritmalarda erishi ionlarning metallning tashqi yuzasida joylashgan atomlarning qutbli suv molekulalari bilan o'zaro ta'siri natijasida ifodalanishi kerak. Erigan metall ionlarining suv dipollari bilan o'zaro ta'siri elektrostatik tortishish kuchlari tufayli yuzaga keladi. Natijada, har bir ion atrofida katta yoki kichik darajada (uning zaryadining kattaligiga qarab) suv dipollari qobig'i hosil bo'ladi (gidratlanish hodisasi). Gidratsiya tufayli ionning samarali radiusi oshadi, buning natijasida gidratlangan ionlarning harakatchanligi sezilarli darajada kamayadi. Suvsizlanish jarayoni energiyaning chiqishi bilan birga keladi, suvsizlanish jarayoni esa energiya talab qiladi. Suv dipollaridan tashqari, ion boshqa dipollarning qobig'i bilan qoplanishi mumkin. Umuman olganda, bu hodisa solvatsiya deb ataladi15. Shunday qilib, elektrokimyoviy korroziya parallel ravishda yuzaga keladigan quyidagi bosqichlardan iborat: - metall ionlarining sirtdan eritmaga o'tishi va ularning hidratsiyasidan iborat bo'lgan anodik jarayon: SOLVATION - erituvchi va erigan moddalar o'rtasida assotsiatsiyalar hosil qilish jarayoni. modda, solvatning mahsuloti SOLVATE. Agar erituvchi suv bo'lsa, u holda HYDRATION, hidratsiya mahsuloti HYDRAT bo'ladi. 15 47 Meº − nē Erkaklar+ + mH2O Erkaklar+ mH2O. gidrat katodli jarayon bo'lib, u elektronlarning ba'zi bir depolarizator (D) tomonidan assimilyatsiya qilinishidan (tutilishidan) iborat: D + nē . Anodik va katodik jarayonlar mustaqil bo'lgani uchun va osonroq sodir bo'ladi: sirtning boshlang'ich potentsiali ko'proq salbiy bo'lgan joylarda anodik va ko'proq ijobiy bo'lgan joylarda - va amaliy sharoitda buning uchun zarur bo'lgan metall sirtining elektrokimyoviy heterojenligi. ta'kidlanganidek, bu jarayonlar asosan mahalliylashtirilgan tarzda sodir bo'ladi. Elektr tokining oqimi metall ustida - elektronlarning anodik maydonlardan katodga o'tishi bilan amalga oshiriladi va eritmada bir vaqtning o'zida ionlarning harakati sodir bo'ladi. Shunday qilib, oqim kuchi elektrokimyoviy korroziya tezligi uchun mezon bo'lib xizmat qilishi mumkin va xizmat qiladi. Anodning moddiy sarfini hisoblang, ya'ni. uning sirtining 1 sm2 qismidagi korroziyaga uchragan metall miqdori Faraday formulasi yordamida ishlatilishi mumkin: K = Q A / F n = i A / F n, bu erda K - korroziyalangan miqdor. metall, g/sm2; Q - anod va katod kesimlari orasidagi t, [s] vaqt ichida oqadigan elektr miqdori; i – oqim zichligi, A/sm2; F - Faraday raqami; n – metallning valentligi; A - metallning atom massasi. 3.4. Elektrod jarayonlarining polarizatsiyasi va uning sabablari Korroziya elementining elektrodlari qisqa tutashganda elektrod potentsiallarida sezilarli o'zgarish sodir bo'ladi, lekin juftlikning qarshiligi amalda o'zgarmaydi. Bunday holda, korroziya elementining elektromotor kuchining pasayishi kuzatiladi. Korroziya oqimining pasayishiga va natijada korroziya tezligining pasayishiga olib keladigan boshlang'ich potentsiallarning o'zgarishi POLARIZATION deb ataladi. Korroziya elementi ishlaganda elektrodlarning potentsiallarining (16) o‘zgarishi katod potentsialining manfiy bo‘lishini (KATOD POLARIZASIYASI), anod potensialining esa musbat bo‘lishini (ANODIK POLARIZATSIYA) ko‘rsatadi: K = Ko – K, (17) o A = A + A, (18) bu yerda K va A ishchi element elektrodlarining potentsial qiymatlari; Kº va Ao – kontaktlarning zanglashiga olib yopilishidan oldingi elektrod potentsiallarining dastlabki qiymatlari; K va A – katod va anodning potentsial siljishi (polyarizatsiyasi). Shunday qilib, E = K - A potentsiallar farqi kamayadi. POLARIZASYON - qisqa tutashgan elementdagi elektronlar oqimidan elektrod jarayonlarining kechikishi natijasidir. Om qarshiliklari (R) korroziya oqimini kamaytirishga juda oz ta'sir qiladi, chunki ular odatda kichikdir. Polarizatsiya qarshiligi katta ahamiyatga ega bo'lib, ular katodda (Pk) elektronlarni tushirishdagi qiyinchiliklar yoki metall panjaradan musbat metall ionlarining eritmaga (PA) o'tishdagi qiyinchiliklar bilan bog'liq. Om o'lchamiga ega bo'lgan bu qarshiliklar elektrokimyoviy korroziya tezligining pasayishining asosiy sababidir. Ohm qonuniga muvofiq kontaktlarning zanglashiga olib yopilish momentidagi oqim kuchi Iinit = (Kº - Ao)/R, (19) formulasi bilan aniqlanadi. Korroziya oqimining boshlang'ich qiymati (Iinit) Kº va Ao boshlang'ich potentsial qiymatlari o'rtasidagi farqga to'g'ridan-to'g'ri proportsionaldir, agar Kº > Ao bo'lsa va qarshilikka teskari proportsionaldir. Barqaror holatdagi korroziya oqimi (Iworking cell) tenglama bilan aniqlanadi: Iworking cell = (K – A)/(R + PA + PK). Shunday qilib, men ishlayman. el−ta< Iнач. Снижению скорости электрохимической коррозии или уменьшению коррозионного тока могут способствовать: − уменьшение степени термодинамической стабильности, т. е. сближение равновесных потенциалов анодного Аº и катодного Кº процессов; − торможение катодных процессов, иначе говоря, увеличение катодной поляризуемости РК; 49 − торможение анодных процессов, то есть увеличение анодной поляризуемости РА. Поляризация является весьма желательным явлением в коррозионных процессах, так как электроды замкнуты накоротко, омическое сопротивление их невелико и, следовательно, не будь поляризационных сопротивлений, коррозия протекла бы весьма интенсивно. Всякое воздействие, уменьшающее поляризацию, увеличивает скорость коррозионных процессов. Факторы, уменьшающие поляризацию электродов коррозионного элемента, называют ДЕПОЛЯРИЗАТОРАМИ, а процессы, протекающие при этом – АНОДНОЙ И КАТОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ. 3.4.1. Анодная поляризация Анодная поляризация обычно оказывает меньшее влияние на изменение разности потенциалов элемента по сравнению с катодной поляризацией. Анодный процесс, заключающийся в ионизации металла и гидратировании ионов по уравнению: Men+ + mH2O → Men+ ∙ mH2O, может протекать беспрепятственно только при условии беспрерывного отвода образующихся ионов из прианодной зоны. Торможение анодного процесса будет иметь место и в случае отставания скорости выхода ионов металла в раствор от скорости перетекания электронов на катодные участки. В результате анодной поляризации отрицательный заряд на металлической обкладке двойного слоя уменьшается, а следовательно, потенциал металла сдвинется в положительную сторону (или станет менее отрицательны). Таким образом, анодная поляризация происходит или в связи с тем, что скорость анодного процесса не поспевает за скоростью отвода электронов (перенапряжение ионизации металла), или потому, что из−за недостаточно быстрого отвода перешедших в раствор ионов металла повышается концентрация этих ионов в прианодной зоне (концентрационная поляризация). Чем легче протекает анодный процесс, тем меньше его поляризуемость. Следить за тем, легко ли протекает анодный процесс или он заметно тормозится, можно по ходу поляризационной анодной кри50 Потенциал, В вой. Эта кривая показывает зависимость потенциала электрода от плотности анодного тока на нем. Такая кривая показана на рис. 10. Удаление продуктов анодной реакции вызывает деполяризацию анода. Деполяризация анода может быть ускорена перемешиЕ Е ванием раствора, образованием о А таких продуктов коррозии, которые выпадают в осадок, а также путем образования комплексных соединений. Вследствие связывания в комплекс ионов металла, перешедших в раствор, концентрация их в прианодной зоне уменьшаПлотность тока, мА/см2 ется; анодная поляризация сниРис. 10. Анодная поляризаци- жается и переход ионов в расонная кривая твор, т.е. коррозия, усиливается. Например, медь и ее сплавы образуют в растворе аммиака хорошо растворимый комплексный ион 2+. Этим объясняется сильная коррозия меди и ее сплавов в аммиачных растворах. Поляризация анодного процесса в обычных условиях происходит в незначительной степени. Исключение представляет случай возникновения анодной пассивности. 3.4.2. Катодная поляризация Протекание катодной реакции могут тормозить два основных процесса: − торможение за счет трудности протекания самой реакции присоединения электрона деполяризатором, т. е. задержка в реакции nē + D (Dnē). Затруднение протекания катодного процесса по этой причине называется ПЕРЕНАПРЯЖЕНИЕМ РЕАКЦИИ КАТОДНОЙ ДЕПОЛЯРИЗАЦИИ; − торможение в процессе подвода к катодной поверхности деполяризатора (D) или отвода от катодной поверхности продуктов восстановления деполяризатора (Dnē). Затруднение катодного процесса по этой причине называется КОНЦЕНТРАЦИОННОЙ ПОЛЯРИЗАЦИЕЙ КАТОДА. 51 Всякий процесс захвата электрона на катоде, т.е. всякий процесс восстановления какого−либо вещества может являться катодной деполяризующей реакцией. Деполяризация катода может протекать различными путями: − ассимиляция электронов ионами: 2H+ +2ē H2, Fe3+ + ē Fe2+, Cu2+ + ē Cu+, S2O8– + ē 2SO42–; − ассимиляция электронов нейтральными молекулами: О2 + 4ē + 2Н2О 4ОН–, Cl2 + 2ē 2Cl–, Н2О2 + 2ē 2ОН–; − ассимиляция электронов нерастворимыми пленками Fe3O4 + 2ē + H2O 3FeO + 2OH–, Fe(OH)3 + ē Fe(OH)2 + OH–; − ассимиляция электронов органическими соединениями RO + 2ē + 4H+ RH2 + H2O, R + 2ē + 2H+ RH2, где R – радикал или органическая молекула. Наиболее часто встречаемыми и наиболее важными катодными деполяризационными процессами являются два: а) разряд и выделение водорода (деполяризатор ион водорода) 2H+ +2ē H2. В этом случае коррозионный процесс называется коррозией с ВОДОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ. Этому виду коррозии подвержены электроотрицательные металлы в кислотах и весьма электроотрицательные металлы, например Mg, в воде и нейтральных растворах электролитов; б) восстановление атомов или молекул кислорода электронами, притекающими на катодных участках − КИСЛОРОДНАЯ ДЕПОЛЯРИЗАЦИЯ: О2 + Н2О + 4ē 4ОН–. Деполяризатором здесь является растворенный в электролите кислород. Этот вид коррозии является наиболее распространенным. Так корродирует большинство металлов в атмосфере, почве, нейтральных растворах электролитов. Иногда оба деполяризующие процесса протекают параллельно, как например, при коррозии железа в разбавленных растворах серной кислоты в присутствии кислорода воздуха. 52 3.4.3. Водородная деполяризация Протекание коррозии металла с водородной деполяризацией возможно, если (Me)обр < (н2)обр. (20) Согласно уравнению Нернста (н2)обр = (н2)ºобр + (RT2,3/F)lg(aH+/pH21/2), (21) о где (н2) обр – стандартный обратимый потенциал водородного электрода при всех температурах (при ан+ = 1 и рН2 = 1 ат); R – универсальная газовая постоянная. Ниже приведены значения обратимого потенциала водородного электрода (н2)обр при 25 оС и различных значениях рН среды и pН2. рн2, ат 5∙10 1 –7 0 + 0,186 0 рН среды 7 − 0,228 − 0,414 14 − 0,641 − 0,828 Изменение потенциала катода при катодной деполяризации выделением водорода подчиняется ближе всего логарифмической зависимости от плотности тока. Эта зависимость определяется выражением: К = Кº – (а + b lg i). (22) Для очень малых плотностей катодного тока (меньше 10–4 – 10–5 А/см2) потенциал от плотности тока имеет линейную зависимость. Поэтому при i = 0 К = Кº, а не бесконечности, как это следует из уравнения. Поляризуемость катода при выделении на нем водорода принято определять ВЕЛИЧИНОЙ ПЕРЕНАПРЯЖЕНИЯ ВОДОРОДА на данном материале катода. Под ПЕРЕНАПРЯЖЕНИЕМ ВОДОРОДА понимают сдвиг потенциала катода при данной плотности тока в отрицательную сторону по сравнению с потенциалом водорода в том же растворе (без наложения тока) и обозначают через η η = − (К − Кº) (23) или η = a + blgI, (24) где b – константа, не зависящая от материала, рассчитывается как 2,3 ∙ 2RT / nF; а − константа, зависит от природы и состояния поверхности материала катода и численно равна величине перенапряжения при плотности тока, равной единице. 53 Поляризационная кривая для случая водородной деполяризации имеет вид кривой Кº MN (рис. 11). − N 1 M η Рис. 11. Катодная поляризационная кривая для процесса водородной деполяризации ко или (н2)обр i1 0 i P Если по оси абсцисс взять не плотность тока, а логарифм этой величины, то кривая перенапряжения будет прямой. В этом случае константа b является тангенсом угла наклона полученной прямой к оси абсцисс, константа а равна величине ординаты lg i = 0 (т.е. при плотности тока i = 1). Величина перенапряжения водорода зависит от плотности тока, т.е. при данной силе тока, от истинных размеров поверхности катода. При одинаковой силе тока она больше на гладкой поверхности, чем на шероховатой. 3.4.4. Кислородная деполяризация Процессы коррозии с КИСЛОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ могут протекать в том случае, если при данных условиях обратимый потенциал металла отрицательнее обратимого потенциала кислородного электрода (Me)обр < (О2)обр. (25) 54 Обратимый потенциал кислородного электрода может быть вычислен по уравнению Нернста: (О2)обр = (О2)ºобр + (RT2,3/4F)lg(pО2/a4ОH−) (26) где (О2)ºобр – стандартный обратимый потенциал кислородного электрода (при аOH– = 1 и рО2 = 1 ат); рО2 – парциальное давление кислорода; аОН– – активность гидроксильных ионов. Величина обратимого потенциала кислородного электрода (О2)ºобр при 25 oC для различных значений рН и рО2: рН среды ро2 , ат 0,21 1 0 + 1,218 + 1,229 7 + 0,805 + 0,815 14 + 0,391 + 0,400 Коррозия с кислородной деполяризацией является термодинамически более возможным процессом, чем коррозия с водородной деполяризацией, так как равновесный потенциал восстановления кислорода более положителен, чем равновесный потенциал выделения водорода. Коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом. Коррозии с кислородной деполяризацией подвергаются металлическая обшивка нефтезаводской аппаратуры и оборудования, детали аппаратов, соприкасающиеся с водой и нейтральными водными растворами солей (например, трубы конденсационно−холодильного оборудования), подземные трубопроводы, днища резервуаров и др. При коррозии металлов с кислородной деполяризацией катодный процесс определяется перенапряжением катодной реакции и скоростью подвода кислорода к электроду. Замедленность катодной реакции по схеме: О2 + 2Н2О + 4е 4ОН– (в щелочных или нейтральных растворах), или по схеме: О2 + 4Н+ + 4е 2Н2О (в слабо−кислых растворах) называется ПЕРЕНАПРЯЖЕНИЕМ ИОНИЗАЦИИ КИСЛОРОДА. При больших плотностях тока (при iк > 10–2 A/m2) va katodga kislorod yetkazib berishning sezilarli tezligi, kislorodning ionlanishining haddan tashqari kuchlanishi oqim zichligiga logarifmik bog'liqlikka ega 55 d" = a"+ b" log i, (27) bu erda d" kislorod ionlanishining haddan tashqari kuchlanishi; a" - katod materialiga va uning sirtining holatiga, haroratga va boshqa omillarga bog'liq bo'lgan konstanta. U i = 1 da haddan tashqari kuchlanish qiymati sifatida sonli aniqlanadi; b" - katod materialiga bog'liq bo'lmagan doimiy; u b" = 2RT/nF ∙ 2,3 tengligidan aniqlanadi; 20 ° va n = 1 haroratda, b" = 0,117. Kislorodning katodli qaytarilish mexanizmi ancha murakkab va bir necha bosqichda sodir bo'ladi: elektrolitda kislorodning erishi, erigan kislorodning metallning katod bo'limlariga o'tishi, kislorodning ionlanishi. Konsentratsiyali polarizatsiya deyarli ahamiyatsiz bo'lgan vodorod depolarizatsiyasidan farqli o'laroq, kislorod depolarizatsiyasi bilan metallarning korroziyasida katodga kislorod etkazib berish tezligi cheklanganligi sababli u juda muhim rol o'ynaydi. Bu elektrolitlar eritmasida kislorodning past eruvchanligi va shuning uchun uning past konsentratsiyasi, katodga tutashgan suyuqlikning statsionar qatlami orqali kislorod tarqalishining qiyinligi bilan izohlanadi. Eritmani kuchli aralashtirish, qizg'in aylanish yoki elektrolitning sezilarli aeratsiyasini ta'minlaydigan sharoitlarda korroziya jarayoni kislorod ionlanishining haddan tashqari kuchlanishi bilan inhibe qilinadi. Diffuziya jarayonlari metallni sokin yoki ozgina aralashtirilgan eritmaga botirganda korroziya tezligiga ta'sir qiladi. Umumiy katod polarizatsiya egri chizig'i murakkab shaklga ega (12-rasm) va kislorodning ionlanishi (AB), kontsentratsiyaning qutblanishi (DE) va vodorod ionlarining ajralishi (GFH) paytida qutblanishni tavsiflovchi uchta egri chiziqning jamidir. Birinchi bo'limda katodik jarayonning tezligi, ya'ni. vaqt birligida kamaygan kislorod miqdori diffuziya orqali sirtga kislorod yetkazib berishning maksimal mumkin bo'lgan tezligidan kamroq. Shu munosabat bilan, bu sohada jarayonning tezligi asosan kislorodni kamaytirish jarayonining sekinligi bilan cheklanadi. 56 − H F K E G (H2)arr 0 (O2)arr A D B C id i 12-rasm Kislorod depolarizatsiyasi jarayoni uchun katod qutblanish egri chizig‘i Tok zichligi yanada ortishi bilan potentsial manfiy yo‘nalishga, birinchi navbatda, asta-sekin siljiydi. va keyin keskin (CDE bo'limi). Potensialning salbiy yo'nalishda keskin siljishi kislorod kontsentratsiyasining pasayishi tufayli kontsentratsiyaning polarizatsiyasi bilan bog'liq. Muayyan potentsial qiymatda, odatda vodorod depolarizatsiyasi bilan bog'liq bo'lgan yangi katodik jarayon mumkin bo'ladi (EK bo'limi). 3.5. Korroziyani nazorat qiluvchi omil Metall va qotishmalarning elektrokimyoviy korroziyasi jarayoni elementar jarayonlar yoki bosqichlardan iborat. Korroziya jarayonining haqiqiy tezligi to'g'ridan-to'g'ri har bir bosqichda uning to'liq inhibisyoniga bog'liq. Uning har bir bosqichida umumiy jarayonni inhibe qilish foizi ma'lum bir bosqichda JARAYONNING NAZORAT DARAJASINI tavsiflaydi. 57 korroziya tezligini aniqlaydigan bosqich deb ataladi, chunki u boshqa bosqichlarga nisbatan eng katta qarshilikka ega. JARAYONNI BOSHQARISH o2)arr imax I imax b b b a (o2)arr in A A imax (Me)arr (Me)arr K ∆Karr (K R2) I I S (o2)arr i I g g d d rasm. 13. Elektrokimyoviy korroziya jarayonlarini kuzatishning asosiy amaliy holatlari uchun qutblanish korroziya diagrammalari 58 I in Amaliy sharoitlarda metallar va qotishmalarning elektrokimyoviy korroziyasini kuzatishning bir necha asosiy holatlari mavjud bo'lib, ular N.D. Tomashov. Bekkerev I.V. "Metallar va qotishmalar - sinflar, kimyoviy tarkibi", 2-qism, Ulyanovsk: Ulyanovsk davlat texnika universiteti, 2007. - s. 630, http://www.bibliotekar.ru/spravochnik-73/index.htm. 3]. Semenova I.V. Korroziya va korroziyadan himoya qilish, M.: Fizmatlit, 2002, 335 b. 4]. Haldeev G.V., Borisova T.F. “Metallar va qotishmalarning korroziya-elektrokimyoviy jarayonlarda vodorod o'tkazuvchanligi. Elektrokimyo" - 30-jild, Moskva, 1989 bet. 232 5]. T. L. Lukanina, T. T. Ovchinnikova, V. Ya Sigaev, "Umumiy kimyo" II qism. Qo'llanma. 2-nashr, tuzatilgan va kengaytirilgan, 2006)