Rezistența chimică a materialelor de construcție în funcție de compoziția și structura lor. Proprietățile tehnologice ale materialelor. Rezistența chimică a materialelor Vladislav Aleksandrovich Lihachev x Principalul curs de lucru
Ministerul Învățământului General și Profesional
Federația Rusă
UNIVERSITATEA DE STAT DE INGINERIA MEDIULUI MOSCOVA
A.G.Parshin V.S.Pakhomov D.L.Lebedev
Rezistența chimică a materialelor și protecția împotriva coroziunii
Atelier de laborator
Editat de Dr. Tech. Științe A.A. Shevchenko
Moscova-1998
BBK35.11 Χ 46
Recenzători:
Departamentul de coroziune, Academia de Stat de Petrol și Gaze din Moscova numit după. Gubkin;
Ph.D. tehnologie. Sciences A.S. Abramov, compania de mediu „ShanEco”, Moscova.
Aprobat ca ajutor didactic de către consiliul editorial și de publicare al Universității de Stat de Inginerie a Mediului din Moscova.
Parshin A.G., Pakhomov V.S., Lebedev D.L.
Χ 46 Rezistenta chimica a materialelor si protectia anticoroziva: Atelier de laborator / Ed. A.A. Shevchenko - M.: MSUIE, 1998.-80 p.; bolnav.8.
ISBN 5-230-11142-9
Atelierul conține patru lucrări de laborator privind coroziunea electrochimică și protecția metalelor: „Influența eterogenității structurale asupra coroziunii metalelor în timpul reducerii ionilor de hidrogen”, „Coroziunea metalelor cu depolarizare a oxigenului”, „Potențialele electrozilor”, „Coroziunea de contact”. și protecția catodică a metalelor împotriva coroziunii”. Sunt prezentate conceptele de bază ale teoriei coroziunii electrochimice a metalelor și metodologia de desfășurare a cercetării coroziunii. Conceput pentru studenții anilor 3 și 4 cu normă întreagă care studiază cursul de rezistență chimică a materialelor și protecția împotriva coroziunii.
ISBN 5-230-11142-9 UDC620.193 BBK 35.11
© A.G.Parshin, V.S.Pakhomov, D.L.Lebedev.1998
© MSUIE, 1998
Prefaţă
Atelierul de laborator este redactat în conformitate cu programul de curs „Rezistența chimică a materialelor și protecția împotriva coroziunii”, prevăzut în programa unui număr de specialități. Atelierul a inclus lucrări privind coroziunea electrochimică a metalelor, care a fost dezvoltată la Departamentul de Materiale Compozite și Protecție împotriva Coroziunii.
Fiecare lucru de laborator începe cu o parte teoretică. Sunt luate în considerare mecanismul, termodinamica și cinetica coroziunii în timpul reducerii catodice a ionilor de hidrogen, depolarizarea oxigenului, procesele de echilibru și neechilibru la interfața metal-electrolit și teoria potențialelor electrodului.
Atunci când se prezintă probleme teoretice, sunt utilizate concepte electrochimice moderne despre mecanismul și cinetica proceselor de coroziune.
Efectuarea lucrărilor de laborator permite studenților să înțeleagă mai bine elementele fundamentale ale studiului coroziunii și protecției metalelor și, de asemenea, le insuflă abilități în efectuarea cercetărilor de bază de coroziune-electrochimice de laborator.
Păstrarea unui jurnal de laborator
1) titlul și scopul lucrării;
2) schema de instalare;
3) un tabel cu rezultatele experimentelor și prelucrarea acestora (calcule, grafice);
4. Concluzii.
Jurnalul trebuie păstrat ordonat și imediat curat, de ex. în același mod în care se păstrează evidența tuturor activităților de cercetare și testare.
Diagrama de instalare trebuie să fie clară și de înțeles, fără explicații verbale.
Este necesar să se asigure condițiile experimentale: materiale testate, suprafața probelor, compoziția și concentrația electroliților, temperatură etc.
Rezultatele testelor trebuie înregistrate în tabele pre-compilate, ale căror forme sunt date în descrierea lucrării.
La înregistrarea diferitelor cantități, este necesar să se indice dimensiunea acestora. Rezultatele măsurătorilor, de regulă, sunt supuse unei prelucrări suplimentare - analitice și grafice (calculul masei, indicatorilor de volum și adâncime ai coroziunii, potențiale etc.). În aceste cazuri, este necesar să se furnizeze formula de calcul și un calcul integral, adică. cu înlocuirea valorilor experimentale în formulă și pentru alte calcule similare - doar rezultatele finale.
Pe baza rezultatelor obținute și prelucrate în consecință, trebuie trase scurte concluzii despre munca depusă. După finalizare, trimiteți jurnalul cu date experimentale profesorului pentru o viză.
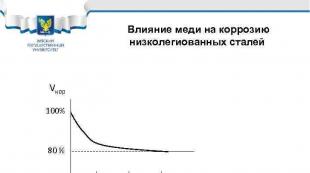
 Influența cuprului asupra coroziunii oțelurilor slab aliate Vcor 100% 80% 0. 1 0. 2 0. 3% Cu Exemple de oțeluri: 10 HSND, 10 G 2 S 1 D, 10 KhDNP, 09 G 2 D, 18 G 2 AF(D)
Influența cuprului asupra coroziunii oțelurilor slab aliate Vcor 100% 80% 0. 1 0. 2 0. 3% Cu Exemple de oțeluri: 10 HSND, 10 G 2 S 1 D, 10 KhDNP, 09 G 2 D, 18 G 2 AF(D)
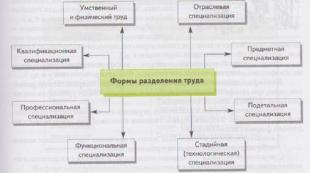
 Clasificarea oțelurilor rezistente la coroziune 1. Oțelurile și aliajele rezistente la coroziune (inoxidabil) sunt materiale care rezistă la coroziune electrochimică în electroliți. 2. Principalul element de aliere al aliajului rezistent la coroziune este cromul. 3. Cromul este introdus în oțelurile inoxidabile în conformitate cu regula lui Tammann. 4. În funcție de mediile în care sunt utilizate aceste oțeluri, se disting cinci grupe de oțeluri și aliaje rezistente la coroziune (inoxidabil).
Clasificarea oțelurilor rezistente la coroziune 1. Oțelurile și aliajele rezistente la coroziune (inoxidabil) sunt materiale care rezistă la coroziune electrochimică în electroliți. 2. Principalul element de aliere al aliajului rezistent la coroziune este cromul. 3. Cromul este introdus în oțelurile inoxidabile în conformitate cu regula lui Tammann. 4. În funcție de mediile în care sunt utilizate aceste oțeluri, se disting cinci grupe de oțeluri și aliaje rezistente la coroziune (inoxidabil).
 Oțeluri rezistente la coroziune pentru medii ușor agresive Oțelurile din primul grup pot funcționa numai în atmosferă închisă și coroziune subacvatică cu uscare periodică obligatorie. În condiții de atmosferă deschisă și coroziune subacvatică constantă (în special în apă caldă), precum și coroziune subterană, aceste oțeluri sunt supuse coroziunii prin pitting. Aceste oțeluri includ oțeluri cromate: 08 X 13, 09 X 13, 08 X 17 G (feritic), 10 X 13, 12 X 13 (martensitic-feritic), 20 X 13, 30 X 13, 40 X 13 (martensitic) . Precum și oțeluri crom-mangan și crom-nichel cu aliere economică de nichel (2 -4%) 15 X 17 AG 14, 10 X 14 AG 15, 10 X 14 G 14 N 3 T, 12 X 17 G 14 N 3 , 08 X 18 G 8 N 2 T
Oțeluri rezistente la coroziune pentru medii ușor agresive Oțelurile din primul grup pot funcționa numai în atmosferă închisă și coroziune subacvatică cu uscare periodică obligatorie. În condiții de atmosferă deschisă și coroziune subacvatică constantă (în special în apă caldă), precum și coroziune subterană, aceste oțeluri sunt supuse coroziunii prin pitting. Aceste oțeluri includ oțeluri cromate: 08 X 13, 09 X 13, 08 X 17 G (feritic), 10 X 13, 12 X 13 (martensitic-feritic), 20 X 13, 30 X 13, 40 X 13 (martensitic) . Precum și oțeluri crom-mangan și crom-nichel cu aliere economică de nichel (2 -4%) 15 X 17 AG 14, 10 X 14 AG 15, 10 X 14 G 14 N 3 T, 12 X 17 G 14 N 3 , 08 X 18 G 8 N 2 T
 Oțeluri rezistente la coroziune (inoxidabil) pentru medii saline Al doilea grup de oțeluri rezistente la coroziune (inoxidabil) este utilizat în medii saline la temperaturi scăzute, în special în timpul coroziunii marine. Rezistența crescută la coroziune este obținută prin aliarea suplimentară economică a oțelurilor Ni (5 – 8%). Exemple: 09 X 15 N 8 Yu, 07 X 16 N 6, 08 X 17 N 5 M 3 (oțelul este utilizat în medii cu acid sulfuric), 09 X 17 N 7 Yu 1 (oțelul este utilizat în condiții de coroziune marine).
Oțeluri rezistente la coroziune (inoxidabil) pentru medii saline Al doilea grup de oțeluri rezistente la coroziune (inoxidabil) este utilizat în medii saline la temperaturi scăzute, în special în timpul coroziunii marine. Rezistența crescută la coroziune este obținută prin aliarea suplimentară economică a oțelurilor Ni (5 – 8%). Exemple: 09 X 15 N 8 Yu, 07 X 16 N 6, 08 X 17 N 5 M 3 (oțelul este utilizat în medii cu acid sulfuric), 09 X 17 N 7 Yu 1 (oțelul este utilizat în condiții de coroziune marine).
 Oţelurile destinate utilizării în medii cu corozivitate medie Medii cu corozivitate medie înseamnă soluţii de săruri la diferite temperaturi, precum şi soluţii slabe ale unor acizi. Oțelurile din a treia grupă sunt cele mai comune oțeluri inoxidabile cu aplicație largă. Dintre aceste oțeluri putem distinge: a) oțeluri - înlocuitori de oțeluri cu conținut ridicat de nichel: 15 X 25 T, 15 X 28, 08 X 22 N 6 T, 12 X 21 N 5 T. b) oțeluri cu un optim crom la nichel raport (Cr: Ni = 18: 9, 18: 10): 12 X 18 N 9 T și 12 X 18 N 10 T, 17 X 18 N 9, 12 X 18 N 10 B, 08 X 18 N 10, 12 X 18 N 12 T, 08 X 18 N 12 B, 06 X 18 N 11 etc.
Oţelurile destinate utilizării în medii cu corozivitate medie Medii cu corozivitate medie înseamnă soluţii de săruri la diferite temperaturi, precum şi soluţii slabe ale unor acizi. Oțelurile din a treia grupă sunt cele mai comune oțeluri inoxidabile cu aplicație largă. Dintre aceste oțeluri putem distinge: a) oțeluri - înlocuitori de oțeluri cu conținut ridicat de nichel: 15 X 25 T, 15 X 28, 08 X 22 N 6 T, 12 X 21 N 5 T. b) oțeluri cu un optim crom la nichel raport (Cr: Ni = 18: 9, 18: 10): 12 X 18 N 9 T și 12 X 18 N 10 T, 17 X 18 N 9, 12 X 18 N 10 B, 08 X 18 N 10, 12 X 18 N 12 T, 08 X 18 N 12 B, 06 X 18 N 11 etc.
 Oțeluri pentru utilizare în medii cu corozivitate crescută Aceste tipuri de oțeluri au fost dezvoltate pentru a crește rezistența chimică în soluțiile fierbinți de Na. Cl şi în soluţii acide. Pentru a crește rezistența oțelurilor, se utilizează aliaje suplimentare cu molibden și cupru, iar în oțelurile din acest grup se străduiesc adesea să mențină o structură austenitică, ceea ce este convenabil din punct de vedere tehnologic, care necesită o aliere suplimentară a oțelurilor cu nichel. Datorită conținutului ridicat de componente de aliere, în principal nichel, oțelurile din acest grup sunt destul de scumpe. Exemple de oțeluri din grup sunt: 10 X 17 N 13 M 2 T 08 X 17 N 13 M 3 T, 08 X 17 N 15 M 3 T, 04 X 28 MDT, 03 X 28 MDT, 06 X 28 MT.
Oțeluri pentru utilizare în medii cu corozivitate crescută Aceste tipuri de oțeluri au fost dezvoltate pentru a crește rezistența chimică în soluțiile fierbinți de Na. Cl şi în soluţii acide. Pentru a crește rezistența oțelurilor, se utilizează aliaje suplimentare cu molibden și cupru, iar în oțelurile din acest grup se străduiesc adesea să mențină o structură austenitică, ceea ce este convenabil din punct de vedere tehnologic, care necesită o aliere suplimentară a oțelurilor cu nichel. Datorită conținutului ridicat de componente de aliere, în principal nichel, oțelurile din acest grup sunt destul de scumpe. Exemple de oțeluri din grup sunt: 10 X 17 N 13 M 2 T 08 X 17 N 13 M 3 T, 08 X 17 N 15 M 3 T, 04 X 28 MDT, 03 X 28 MDT, 06 X 28 MT.
 Aliaje pe bază de nichel pentru medii foarte agresive Mediile cu agresivitate foarte mare sunt înțelese ca soluții fierbinți de acizi sulfuric și clorhidric. În astfel de medii agresive, cele mai rezistente materiale metalice sunt aliajele pe bază de nichel. De exemplu, aliajul KhN 65 MV este stabil la temperaturi ridicate în medii cu acid sulfuric și clorhidric, în acid acetic concentrat. Aliajul N 70 MF este recomandat pentru utilizare în soluții de acid sulfuric și clorhidric, aliajul este mai rezistent la coroziune intergranulară.
Aliaje pe bază de nichel pentru medii foarte agresive Mediile cu agresivitate foarte mare sunt înțelese ca soluții fierbinți de acizi sulfuric și clorhidric. În astfel de medii agresive, cele mai rezistente materiale metalice sunt aliajele pe bază de nichel. De exemplu, aliajul KhN 65 MV este stabil la temperaturi ridicate în medii cu acid sulfuric și clorhidric, în acid acetic concentrat. Aliajul N 70 MF este recomandat pentru utilizare în soluții de acid sulfuric și clorhidric, aliajul este mai rezistent la coroziune intergranulară.
 Creșterea densității betonului 4. Introducerea aditivilor polimerici 4. 1. introducerea unei cantități mici de aditivi polimerici 0,2 - 3% în amestecul de beton (latexuri, rășini polimerice); 4. 2. producerea betonului pe bază de liant polimeric (soluții polimerice și beton polimeric); Furnizat sub formă de amestec uscat și întăritor în cutii. 4. 3. impregnarea betonului gata preparat și a produselor din beton armat cu compuși polimerici sau monomeri cu polimerizarea lor ulterioară direct în corpul de beton (polimeri de beton); 4. 4. armarea betonului cu fibre polimerice (producerea betonului armat cu fibre)
Creșterea densității betonului 4. Introducerea aditivilor polimerici 4. 1. introducerea unei cantități mici de aditivi polimerici 0,2 - 3% în amestecul de beton (latexuri, rășini polimerice); 4. 2. producerea betonului pe bază de liant polimeric (soluții polimerice și beton polimeric); Furnizat sub formă de amestec uscat și întăritor în cutii. 4. 3. impregnarea betonului gata preparat și a produselor din beton armat cu compuși polimerici sau monomeri cu polimerizarea lor ulterioară direct în corpul de beton (polimeri de beton); 4. 4. armarea betonului cu fibre polimerice (producerea betonului armat cu fibre)

 Modulul 7. Metode de protejare a metalelor împotriva coroziunii electrochimice. Cursul 7. 3 PROTECȚIA ELECTROCHIMICĂ A METALELOR DE COROZIUNE Protecția catodică constă în deplasarea potențialului metalului unei structuri corozive către partea negativă prin conectarea acestuia la polul negativ al sursei de curent.
Modulul 7. Metode de protejare a metalelor împotriva coroziunii electrochimice. Cursul 7. 3 PROTECȚIA ELECTROCHIMICĂ A METALELOR DE COROZIUNE Protecția catodică constă în deplasarea potențialului metalului unei structuri corozive către partea negativă prin conectarea acestuia la polul negativ al sursei de curent.
 Modulul 7. Metode de protejare a metalelor împotriva coroziunii electrochimice. Curs 7. 3 Diagrama de coroziune a protecției catodice
Modulul 7. Metode de protejare a metalelor împotriva coroziunii electrochimice. Curs 7. 3 Diagrama de coroziune a protecției catodice
 Modulul 7. Metode de protejare a metalelor împotriva coroziunii electrochimice. Cursul 7. 2 Protecția de protecție se bazează pe caracteristicile de coroziune a două metale în contact. Conform teoriei coroziunii de contact, atunci când un metal pozitiv M 2 intră în contact cu un metal mai negativ M 1, potențialul metalului M 2 se deplasează pe partea negativă, iar coroziunea sa scade sau se oprește complet.
Modulul 7. Metode de protejare a metalelor împotriva coroziunii electrochimice. Cursul 7. 2 Protecția de protecție se bazează pe caracteristicile de coroziune a două metale în contact. Conform teoriei coroziunii de contact, atunci când un metal pozitiv M 2 intră în contact cu un metal mai negativ M 1, potențialul metalului M 2 se deplasează pe partea negativă, iar coroziunea sa scade sau se oprește complet.
 Modulul 7. Metode de protejare a metalelor împotriva coroziunii electrochimice. Cursul 7. 3 Protecția anodică este utilizată numai pentru metalele predispuse la pasivare într-un mediu coroziv. Se reduce la deplasarea potențialului metalului din regiunea de dizolvare activă în regiunea de pasivare folosind o sursă de curent externă.
Modulul 7. Metode de protejare a metalelor împotriva coroziunii electrochimice. Cursul 7. 3 Protecția anodică este utilizată numai pentru metalele predispuse la pasivare într-un mediu coroziv. Se reduce la deplasarea potențialului metalului din regiunea de dizolvare activă în regiunea de pasivare folosind o sursă de curent externă.
 Modulul 7. Metode de protejare a metalelor împotriva coroziunii electrochimice. Cursul 7. 3 Diagrama de coroziune a protecției anodice
Modulul 7. Metode de protejare a metalelor împotriva coroziunii electrochimice. Cursul 7. 3 Diagrama de coroziune a protecției anodice
MINISTERUL EDUCAȚIEI ȘI ȘTIINȚEI FEDERAȚIEI RUSĂ INSTITUȚIA DE ÎNVĂȚĂMÂNTUL FEDERAL DE STAT PROFESIONAL SUPERIOR „UNIVERSITATEA TEHNOLOGICĂ DE STAT A POLIMERILOR PLANTELOR SÂNTUL PETERSBURG” T. L. Lukanina, I. Mikhailova, M. A. PROFESSIONALĂ DE MATERIALĂ ŞI MATERIALE DE PROTECȚIE −Petersburg 2014 1 UDC 546(075) BBK 24.1я7 L 840 Lukanina T. L., Mikhailova I. S., Radin M. A. Rezistența chimică a materialelor și protecția anticorozivă: manual. manual − Sankt Petersburg: SPbGTURP, 2014. – 85 p. Manualul oferă idei moderne despre termodinamica și cinetica coroziunii chimice, mecanismele și diferitele tipuri de coroziune electrochimică, ținând cont de mediile și condițiile caracteristice echipamentelor din industria chimică. Sunt prezentate principiile științifice ale creării oțelurilor și aliajelor rezistente la coroziune și metodele de protecție a materialelor structurale împotriva coroziunii. Manualul este oferit studenților universităților tehnice și facultăților care studiază în specialități tehnologice. Poate fi util pentru studenții absolvenți, lucrătorii științifici și de inginerie ai întreprinderilor chimice, organizațiile de proiectare și cercetare implicate în protecția metalelor împotriva coroziunii. Recenzători: Dr. Chem. științe, prof. Departamentul de Stat Sankt Petersburg ITMO Chimie. facultatea Slobodov A. A.; Ph.D. chimic. Științe, conferențiar Departamentul de Chimie Organică, Universitatea Tehnică de Stat din Sankt Petersburg din Turkmenistan, Evdokimov A.N. Recomandat pentru publicare de către Consiliul editorial și de publicare al Universității ca material didactic. Editor și corector T. A. Smirnova Tech. Editor L.Ya Titova Templan 2014, poz. 45 _____________________________________________________________ Trimis spre publicare la 14.04.14 Format 60×84/16. Tipul de hârtie nr. 1. Imprimare offset. Tipărit l.5.5. Uch.-ed. 5.5 Tiraj 100 de exemplare Ediția Nr. 45. Prețul „C”. Ivana Chernykh, 4 St. Petersburg State Technological University of Plant Polymers, 2014 Lukanina T. L., Mikhailova I. S., Radin M. A., 2014 2 INTRODUCERE COROZIUNEA materialelor este distrugerea spontană din cauza interacțiunii chimice sau electrochimice cu mediul. Distrugerea metalelor și aliajelor din cauza coroziunii diferă de alte tipuri de distrugere spontană, cum ar fi eroziunea sau uzura, care sunt cauzate de interacțiunea mecanică cu un corp sau mediu. Pentru majoritatea metalelor și aliajelor, în condiții de funcționare, starea oxidată (ionică) este mai stabilă, în care trec ca urmare a coroziunii. Termenul „coroziune” provine din cuvântul latin „corrodere”, care înseamnă „a coroda”. Pierderile cauzate de coroziune sunt de obicei împărțite în directe și indirecte. PIERDERILE DIRECTE includ: − costul metalului care se transformă în produse de coroziune, precum și costul echipamentelor corodate care se defectează înainte de epuizarea perioadei de amortizare prevăzute de condițiile tehnice. Mai mult decât atât, de regulă, costul echipamentelor de fabricație depășește cu mult costul metalului din care este fabricat; − o creștere a toleranțelor de coroziune, ceea ce duce nu numai la creșterea consumului de metal, ci și la deteriorarea designului. De exemplu, pentru o conductă cu același diametru exterior, o cantitate crescută de metal duce la o scădere a secțiunii transversale utile și, în consecință, la o scădere a debitului conductei; − costuri pentru măsurile de protecţie sub formă de acoperiri metalice şi nemetalice, materiale rezistente la coroziune, inhibitori etc. PIERDERILE INDIRECTE din cauza coroziunii sunt cauzate de următoarele motive: − costuri suplimentare pentru reparaţiile neprogramate ale echipamentelor care s-au defectat; − subproducție ca urmare a opririlor pentru reparații ale echipamentelor deteriorate prin coroziune; − posibilitatea producerii de accidente, explozii si incendii; − scurgerile produselor din cauza formării unor orificii traversante în pereții echipamentelor ca urmare a coroziunii; 3 – reducerea secțiunii transversale a conductelor ca urmare a depunerii produselor de coroziune, care necesită un consum suplimentar de energie pentru a menține puterea necesară a curgerii fluidului; − reducerea calității produsului ca urmare a contaminării cu produse de coroziune. Știința coroziunii și a protecției metalelor studiază interacțiunea metalelor și aliajelor cu mediul coroziv, stabilește mecanismul acestei interacțiuni și principiile sale generale. Baza științifică pentru studiul coroziunii și protecției metalelor este știința metalelor și chimia fizică. Scopul practic final al acestei științe este de a proteja împotriva distrugerii corozive a metalelor în timpul procesării și exploatării echipamentelor. Capitolul 1. INFORMAȚII GENERALE DESPRE COROZIUNE 1.1. Termodinamica și cinetica proceselor de coroziune Cauza principală a coroziunii este instabilitatea termodinamică a metalelor în diferite medii în condiții externe date. Posibilitatea fundamentală de apariție spontană a procesului de coroziune este determinată de legile termodinamicii. Apariția oricărui proces spontan este însoțită de o scădere a energiei libere. Posibilitatea apariției spontane a proceselor de coroziune poate fi evaluată prin modificări ale potențialului izobar-izotermic ΔG1. Un proces spontan de oxidare a metalelor - coroziune - este posibil dacă ∆G< 0, то есть знак ―минус‖ означает, что изобарно−изотермический потенциал убывает и свободная энергия системы уменьшается. Наоборот, если ∆G > 0, atunci semnul plus pentru potențialul izobar-izoterm corespunde unei creșteri a energiei libere, ceea ce indică imposibilitatea apariției spontane a acestei reacții. POTENȚIAL ISOBARIC-IZTERMAL (ΔG) – Energia Gibbs, unul dintre potențialele termodinamice, egal cu ΔG = ΔН - TΔS, unde ΔН, ΔS, Т - entalpia, entropia, temperatura termodinamică a sistemului. ΔG este proporțional cu numărul de particule din sistem. Denumită o singură particulă, se numește potențial chimic. ΔG este convenabil pentru descrierea proceselor în care schimbul este posibil între materie și corpurile înconjurătoare. Într-un proces de echilibru izoterm care are loc la presiune constantă, acesta este munca totală a sistemului minus lucrul împotriva forțelor de presiune externe. Este egal cu scăderea potențialului izobar-izoterm (adică, munca utilă maximă). 1 4 Cu toate acestea, deși termodinamica face posibilă determinarea cât de departe este sistemul studiat de starea de echilibru și este capabil de o reacție spontană, aceasta nu indică viteza acestui proces. Viteza de coroziune este determinată de cinetica acesteia. O caracteristică a proceselor de coroziune este natura lor eterogenă. Acest lucru se datorează faptului că distrugerea metalului are loc la interfața dintre două faze care au stări diferite de agregare, de exemplu, la interfața metal-lichid, metal-gaz. În astfel de condiții, factorul determinant pentru cinetica interacțiunii chimice este fie viteza interacțiunii chimice, fie furnizarea de reactivi din volumele fazelor de contact la interfața unde are loc interacțiunea de coroziune și îndepărtarea produselor de reacție în sens opus. direcţie. În primul caz, viteza de coroziune este determinată prin control cinetic, în al doilea - prin controlul difuziei. În unele cazuri, viteza de coroziune este determinată de controlul mixt difuzie-cinetic. Pentru un proces în stare staționară, viteza reacției chimice și viteza de difuzie sunt egale. Procesul de coroziune constă din mai multe etape, care pot avea loc fie secvenţial, fie în paralel. Viteza totală la starea de echilibru a unui proces de coroziune constând din mai multe etape succesive este determinată de viteza celei mai lente etape. Când etapele individuale ale procesului au loc în paralel, viteza totală de coroziune este determinată de etapa cea mai rapidă. Prin urmare, dacă una dintre etape decurge mult mai repede decât cealaltă, a doua etapă poate fi neglijată. 1.2. Clasificarea proceselor de coroziune în funcție de mecanismul de apariție Indiferent de marea varietate de condiții pentru apariția proceselor de coroziune, acestea pot fi clasificate după două caracteristici principale: - după mecanismul procesului - după natura distrugerii coroziunii . Există coroziuni CHIMICE și ELECTROCHIMICE. 5 apare în gazele uscate (coroziunea gazoasă) și în non-electroliții lichizi2 (coroziunea în non-electroliți). Dacă mediul nu este un electrolit (gaze uscate sau neelectroliți lichizi), atunci schimbul de electroni are loc direct între metalul reducător (roșu) și orice substanță care conține un element electronegativ capabil să atragă electroni la sine - agentul oxidant (ox ), de exemplu: Fe + Сl2 → FeCl2 (1) COROZIUNEA CHIMICA roșu Balanța transferului de electroni ox Feº − 2ē → Fe2+ 1 Сl2º + 2ē → 2Cl− Feº + 2Сlº = Fe2+ + 2Cl− COROZIUNEA ELECTROCHIMICĂ este un proces de interacțiune electrochimică metal cu un mediu coroziv (soluție de electrolit), în care Ionizarea atomilor de metal și reducerea componentei oxidante a mediului corosiv nu se produc într-un singur act și ratele acestora depind de potențialul electrodului. Trăsăturile distinctive ale procesului de coroziune electrochimică sunt următoarele: – apariția simultană a două procese separate - oxidativ (dizolvarea metalului) și reducerea (evoluția hidrogenului, reducerea oxigenului, eliberarea metalului din soluție etc.); – procesul de dizolvare a metalului este însoțit de mișcarea direcțională a electronilor în metal și a ionilor în electrolit, adică. apariția curentului electric; – produse de coroziune se formează în urma reacțiilor secundare. Procesele redox care apar în timpul coroziunii electrochimice pot fi prezentate sub forma următoarelor reacții: Ме − nē→ Меn+ (proces anodic) (2) n− R(ox) + nē → R (roșu) (proces catod), (3 ) unde R(ox) este un agent de oxidare; NEELECTROLIȚII sunt substanțe ale căror soluții apoase și topituri nu conduc curentul electric. Ele conțin legături covalente nepolare sau cu polare scăzute care nu se descompun în ioni. Gazele, solidele (nemetale) și compușii organici (zaharoză, benzină, alcool) nu conduc curentul electric. 2 6 R n−(roșu) – formă redusă a agentului oxidant; nē – numărul de electroni transferați. Un exemplu de coroziune electrochimică este procesul de oxidare (rugină) a fierului sub influența apei: Fe − 2ē → Fe2+ (proces anodic - dizolvarea fierului) H2O + ½О2 +2ē → 2OH– (proces catodic - reducerea oxigenului) −−−−−− −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− − Fe 2+ + 2OH – → Fe(OH)2 (formarea produșilor de coroziune) Reacțiile (2) și (3) au loc conjugat, dar respectă propriile legi cinetice. În acest caz, este necesar să se respecte condițiile de staționaritate a procesului, adică. egalitatea ratelor de oxidare a metalelor și de reducere a agentului de oxidare. Aceste reacții pot fi separate geografic și au loc pe diferite părți ale suprafeței. Din condițiile de staționaritate rezultă că este suficientă încetinirea uneia dintre reacțiile conjugate pentru ca viteza întregului proces să scadă. 1.3. Clasificarea proceselor de coroziune în funcție de natura distrugerii coroziunii Pe baza naturii distrugerii prin coroziune a metalului, se disting COROZIUNEA GENERALĂ ȘI LOCALA. COROZIUNEA GENERALĂ se răspândește pe toată suprafața metalului poate fi uniformă sau neuniformă (Fig. 1. - 1.2). 1 2 4 5 7 8 3 6 9 Fig. 1. Tipuri de deteriorare prin coroziune Multe cazuri de coroziune includ coroziune generală, de exemplu, atunci când, ca urmare a expunerii metalului la electroliți, produsele de coroziune nu rămân pe suprafața metalului. Astfel, se observă coroziune generală intensă în timpul interacțiunii cuprului cu acidul azotic, fierului cu acidul clorhidric, aluminiului cu alcalii caustici, zincului cu acid sulfuric etc. Coroziunea generală uniformă este unul dintre cele mai puțin periculoase tipuri de coroziune, cu condiția ca rata de dizolvare a metalului din cauza coroziunii nu depășește standardele determinate de cerințele pentru funcționarea aparatului, dispozitivului etc. Dacă metalul este suficient de gros, coroziunea are un efect redus asupra reducerii rezistenței mecanice a structurii sub solicitări uniform distribuite pe secțiune transversală (tension, compresie). Cu toate acestea, coroziunea generală poate fi periculoasă atunci când piesele sunt supuse la îndoire și torsiune, deoarece în acest caz straturile cele mai încărcate sunt distruse. COROZIUNEA LOCALĂ – provoacă distrugerea doar a unor zone ale suprafeței metalice, iar restul nu suferă distrugeri sau rata de distrugere este foarte mică. Manifestarile coroziunii locale sunt foarte diverse si pot avea diferite grade de denivelare, si de aceea coroziunea locala se imparte in COROZIUNE PRIN PETE, ULCERE, VASOARE (PITTING), COROZIUNE SELECTIVA, COROZIUNE, CRACARE COROSIVA. INTERCRISTALIT Coroziune prin pete, ulcere, puncte - tipurile de coroziune locală diferă în raportul dintre diametrul zonei distruse și adâncimea acesteia (Fig. 1., 4–6). În cazul coroziunii spot, diametrul zonei distruse este mult mai mare decât adâncimea sa, în cazul distrugerii ulcerative, diametrul zonei distruse este proporțional cu adâncimea sa, iar cu coroziunea prin pitting, diametrul zonei distruse este mult mai mic decât adâncimea acesteia. . În unele cazuri, coroziunea prin găuri poate duce la distrugere, ceea ce este deosebit de periculos pentru conducte, rezervoare etc. Coroziunea prin pitting este tipică pentru metalele capabile de pasivare - frânare (crom, aluminiu, oțel inoxidabil etc.). Starea pasivă a metalelor poate fi perturbată în anumite zone mai slabe ale suprafeței, de exemplu în porii unei pelicule de protecție, în locurile incluziunilor intermetalice (oxizi, zguri etc.). COROZIUNEA SELECTIVĂ – se împarte în: component-selectivă (selectivă) sau structural-selectivă (intercristalină). 8 Un exemplu de COROZIUNE SELECTIVĂ DE COMPONENTE este dezincificarea alamei. Dezincificarea alamei3 constă în faptul că zincul trece în electrolit (de obicei la o valoare a pH-ului neutru sau ușor acid) mai intens decât cuprul. Pe suprafața alamei se formează un strat liber de cupru, care contribuie la creșterea coroziunii electrochimice (aspectul unei celule microgalvanice). Un exemplu de coroziune STRUCTURAL-SELECTIVĂ este coroziunea fontei cenușii. Coroziunea selectivă structurală a fontei cenușii constă în distrugerea predominantă a componentei de ferită, având ca rezultat formarea unui schelet de grafit umplut cu produse de coroziune (Fig. 1−3). În același timp, rezistența mecanică a fontei scade brusc. COROZIUNEA INTERCRISTALITĂ este caracterizată prin distrugerea selectivă a metalului de-a lungul granițelor (Fig. 1–7). Ca urmare, cu o mică modificare a masei și aspectului, poate apărea o pierdere foarte semnificativă a proprietăților de rezistență ale metalului (Fig. 2). 40 Fig. 2. Pierderea proprietăților de rezistență ale metalului în timpul diferitelor tipuri de distrugere prin coroziune 1 – coroziune uniformă; 2 – coroziune intergranulară 20 Pierderea w, % 60 2 0 1 2 4 Pierdere în greutate, kg/cm2 În cazuri extreme, cu distrugerea completă a limitelor granulare ca urmare a coroziunii intergranulare, aliajul se poate sfărâma în pulbere. CRACKAREA prin coroziune este un caz de coroziune locală în care distrugerea are loc în direcția perpendiculară pe cea mai mare tensiune de întindere (Fig. 1 - 8). 3 Alama – aliaj cupru-zinc. 9 Este tipic ca, în acest caz, o fisură de coroziune să se poată propaga de-a lungul granițelor de granule sau să taie corpul de cristal. Distrugerea din cauza oboselii de coroziune (cu expunerea simultană la un mediu coroziv și încărcări alternante sau ciclice) se desfășoară într-un mod similar ca în timpul fisurii prin coroziune. COROZIUNEA DE SUPRAFAȚĂ, începând de la suprafață, se răspândește predominant sub suprafață, ceea ce duce adesea la delaminarea și umflarea metalului (Fig. 1− 9), de exemplu, formarea de bule pe tabla de calitate scăzută în timpul procesului de gravare. sau coroziunea în timpul funcționării vaselor și a aparatelor. 1.4. Indicatori de coroziune Pentru cuantificarea vitezei de coroziune se folosesc indicatori de coroziune: MASOMETRICI, VOLUMETRICI, ADÂNCIMI, MECANICI, CURENTUL. 2 Indicele de coroziune MASOMETRIC (Km, g/m ∙h) este modificarea masei metalului ca urmare a coroziunii pe unitatea de suprafață (e) a probei și pe unitatea de timp. Modificarea masei unei probe este de obicei determinată ca diferența dintre masa probei înainte de testare (m®) și masa acesteia după testare (m1) în timp (τ) cu îndepărtarea produselor de coroziune (pierderea de masă metalică) . K m = (m0 − m1)/s ∙ τ . (4) 3 2 Indicele de coroziune VOLUMETRIC (Kν, cm /m h) este volumul (Vo) de gaz absorbit sau eliberat în timpul procesului de coroziune, pe unitatea de suprafață metalică și pe unitatea de timp K m = V0 /s ∙ τ. (5) Indicele de coroziune PROFTH (P, mm/an) ține cont de reducerea grosimii metalului datorată coroziunii, exprimată în unități liniare și pe unitatea de timp. Acest indicator este util atunci când se compară coroziunea metalelor cu densități diferite. Trecerea de la indicatorul masometric la cel de adâncime se poate face, în cazul coroziunii uniforme, folosind formula P = K m ∙ 8,76 /γ, (6) unde γ este densitatea metalului. Indicatorul de coroziune MECANIC este determinat de modificarea unuia dintre principalii indicatori ai proprietăților mecanice ale unui metal într-un anumit timp al procesului de coroziune și este exprimat în unități relative sau procent. Dacă rezistența la tracțiune este utilizată ca indicator mecanic, atunci modificarea indicatorului de rezistență (Kσ) este determinată de formula Kσ = Δσb/σb, (7) unde σb este rezistența la tracțiune înainte de coroziune, ∆σb este modificarea rezistenței la tracțiune a metalului după coroziune în timpul τ. Indicatorul curent de coroziune permite, folosind formula lui Faraday, să se calculeze cantitatea de metal corodat pe baza mărimii curentului de coroziune Km = IA /nF, (8) unde Km este rata de coroziune bazată pe modificare în masă metalică; I – puterea curentului; F – constanta de Faraday; n – valența metalului; A este masa atomică a metalului. La evaluarea calitativă și cantitativă a rezistenței la coroziune a metalelor, se recomandă utilizarea unei scale în zece puncte4. Trebuie remarcat faptul că, deși această scară de evaluare a rezistenței la coroziune a metalelor a devenit mai răspândită, în special în industria chimică, nu este universală, deoarece pentru echipamentele pentru diverse scopuri, ratele de coroziune admisibile pot diferi cu un ordin de mărime sau Mai mult. Tabelul 1 Zece - Scala balică a rezistenței la coroziune a metalelor și aliajelor Grupa de rezistență complet persistentă, foarte persistentă, rezistentă scăzută, viteza de coroziune instabilă, mm/an mai mică de 0,001 peste 0,001 până la 0,005 până la 0,01 până la 0,05 peste 0,05 mai mult . până la 0,1 peste 0,1 până la 0,5 peste 0,5 până la 1,0 peste 1,0 până la 5,0 peste 5,0 până la 10,0 peste 10,0 SCORE 1 2 3 4 5 6 7 8 9 10 Sistem unificat de protecție împotriva coroziunii și îmbătrânirii. Structuri subterane. Cerințe generale pentru protecția împotriva coroziunii. GOST 9.602−2005, http://www.gosthelp.ru/gost/gost206.html 4 11 Capitolul 2. COROZIUNEA CHIMICA A METALELOR Coroziunea chimica a metalelor este un proces spontan de distrugere a acestora datorita interactiunii chimice cu mediul extern. Caracteristicile distinctive ale procesului de coroziune chimică sunt următoarele: – implementarea proceselor de oxidare și reducere într-o singură etapă; – absența curentului electric; – formarea produselor de coroziune direct pe suprafata unde are loc distrugerea acesteia. COROZIA CHIMICA este o reactie heterogena de interactiune intre faza lichida (l) sau gazoasa (g) cu faza (s) solida (s) - metal si se imparte in 2 tipuri (coroziunea gazoasa, coroziunea in neelectroliti lichizi). 2.1. Coroziunea cu gaze În practică, COROZIUNEA cu gaz este cea mai importantă. Cel mai adesea, se manifestă ca coroziune a materialelor metalice la temperaturi ridicate (de zeci de ori mai mare decât punctul de fierbere al apei) într-o atmosferă de gaze care conțin oxigen. Din acest motiv, se numește COROZIUNE LA TEMPERATURĂ ÎNALTĂ sau OXIDARE LA TEMPERATURA ÎNALTĂ. Pe suprafața produselor din metale și aliaje, ca urmare a interacțiunii lor cu un astfel de mediu corosiv, se formează o peliculă de produse reprezentând diferiți oxizi metalici. În același timp, în funcție de condițiile de funcționare, se pot forma și alți compuși, de exemplu, metale sulfuroase5. De exemplu, în industria de rafinare a petrolului, coroziunea gazului afectează, de exemplu, țevile cuptorului, pereții reactorului, coloanele de reacție și alte echipamente expuse la temperaturi ridicate la hidrogen sulfurat, monoxid de carbon, azot, oxigen și alte gaze. Termenul „coroziunea gazoasă” se referă la distrugerea metalelor cauzată de acțiunea vaporilor și gazelor la temperaturi ridicate, deși poate fi aplicat și la temperaturi mai scăzute la 5 METALURI SULFURI, la fel ca și sulfurile. 12 asigurați-vă că o peliculă de lichid care conduce curentul electric nu se condensează pe metal. Pe suprafața produselor din metale și aliaje, ca urmare a interacțiunii lor cu un mediu corosiv, se formează o peliculă de produse reprezentând diferiți compuși metalici. În general, procesul de coroziune chimică poate fi descris, de exemplu, prin reacția de oxidare a metalului cu gazul încălzit (T >>373K) (G2): 2Ме + nГ2 → 2Men+Гn. Într-un mediu cu oxigen, un astfel de proces poate fi descris prin următoarea ecuație Me(T) + ½ O2 ↔ MeO(T). Această reacție este de echilibru la temperaturi ridicate. Procesul invers se numește DISOCIAREA OXIZILOR. Oxigenul prezent într-un mediu gazos se caracterizează prin presiunea sa parțială (pO2). Reacția chimică de oxidare a metalului va fi în echilibru cu reacția de disociere a oxidului dacă presiunea parțială a oxigenului (pO2) și ELASTICITATEA DISOCIEI OXIZILOR (pMeO)7 devin egale (pMeO = pO2) 1. Când pO2 > pMeO, reacția continuă în principal în direcţia formării oxidului. Când pMeO > pO2, reacția se desfășoară predominant în direcția opusă. Oxidarea metalelor este un proces eterogen în mai multe etape, datorită căruia la suprafață se formează mai întâi un strat de oxid mono- și apoi polimolecular, așa-numitul film de oxid. Creșterea grosimii sale poate avea loc fie în ambele direcții simultan (metal și mediu gazos), fie predominant într-una singură (Fig. 3). PRESIUNE PARȚIALĂ (din latină târziu partialis - parțială), presiunea pe care ar avea-o un gaz inclus într-un amestec de gaze dacă singur ar ocupa un volum egal cu volumul amestecului la aceeași temperatură. 7 Presiunea parțială de echilibru a oxigenului pentru reacțiile de formare sau DISOCIERE TERMICĂ a OXIZILOR se numește ELASTICITATEA DISOCIERII OXIDILOR. Valoarea sa este legată de constanta de echilibru a reacției și, prin urmare, este o funcție de temperatură. 6 13 a b c Fig. Fig. 3. Schema mecanismului ion-electronic de formare și creștere a unui film de oxid pe suprafața unei piese metalice Dacă creșterea are loc în direcția unui mediu gazos, atunci se observă o creștere semnificativă a dimensiunii piesei , de exemplu, în timpul oxidării, care trebuie luată în considerare în inginerie mecanică. Direcția de creștere este determinată de raportul dintre ratele de contradifuzie a ionilor metalici Мen+ și oxigenul O2− în interiorul filmului de oxid. Dacă ratele de difuzie ale ionilor metalici (rdif.Me) și ale oxigenului (rdif.O2) diferă foarte mult, atunci creșterea filmului de oxid are loc predominant într-o direcție, de exemplu, cu rdiff.O2< rдиф.Mе − в направлении газовой среды и наоборот (рис. 3, в, б). В большинстве случаев, скорости диффузии ионов металла и кислорода соизмеримы, но для ионов кислорода скорость несколько ниже из−за того, что они больше по размерам, поэтому зона роста, находящаяся в толще самой оксидной пленки, располагается ближе к ее внешней поверхности (рис. 3, а). По мере утолщения оксидной пленки процессы встречной диффузии ионов и электронов затрудняются. С повышением температуры упругость диссоциации оксидов возрастает у всех металлов. Поэтому, начиная от какой−то температуры, когда упругость диссоциации оксида металла становится больше парциального давления кислорода в воздухе (при атмосферном давлении рО2 = 0,21 ат), металл перестает окисляться и становится вполне малоактивным по отношению к кислороду. Так, например, серебро при температуре 300 ºК термодинамически еще не устойчиво, а при 400 ºК и при всех более высоких температурах упругость диссоциации Ag2O превышает парциаль14 ное давление кислорода в воздухе. При температуре 2000 ºК медь тоже становится неокисляемым металлом, однако для таких металлов, как Fе, Zn, Ni и др., даже при этих температурах упругость диссоциации окислов остается еще достаточно низкой и, следовательно, протекание реакции окисления вероятно. Необходимо учесть, что температурная зависимость для кинетики процесса окисления совершенно иная, чем для термодинамической вероятности окисления. Поэтому нет никакого противоречия в том, что термодинамическая вероятность окисления металла с повышением температуры падает, а реальная скорость окисления (при условии, что термодинамически этот процесс остается еще возможным) с повышением температуры возрастает. 2.2. Образование тонких пленок на металлах Ранее было отмечено, что в большинстве случаев образовавшиеся продукты газовой коррозии – оксиды металла остаются на поверхности металла в виде пленки. Эти пленки определяют кинетику процесса и в случае наличия защитных свойств могут привести к замедлению коррозии. Чтобы пленка оксида металла обладала защитными свойствами, она должна быть: − сплошной; − прочно сцепляться с основным металлом и обладать близким к нему коэффициентом теплового расширения; − быть химически инертной по отношению к данной агрессивной среде; − обладать твердостью и износостойкостью. Даже при обычной температуре на поверхности многих металлов и сплавов на воздухе образуются слои оксидов. Еще в 1836 г. М. Фарадей высказал предположение, что даже на блестящей поверхности металлов существует тончайшая, невидимая защитная (оксидная) пленка. Этим он объяснял пассивность железа в азотной кислоте. Если пленка пористая, рыхлая и характеризуется плохим сцеплением с основным металлом, то даже при условии инертности в данной агрессивной среде, она не будет обладать защитными свойствами. Пленки по толщине (δ) делятся на три группы: − тонкие (невидимые), δ < 4000 нм; − средние (дающие цвета побежалости), δ = от 4000 до 50000 нм; 15 − толстые (видимые), δ > 50000 nm. Grosimea filmelor formate în timpul interacțiunii metalului cu aerul uscat este diferită și depinde de tipul de metal, temperatură și alți factori. Astfel, grosimea filmelor pe cupru și fier la temperatura camerei este de 100–300 nm, iar pe aluminiu 1000–1500 nm. Să dăm câteva exemple care demonstrează prezența peliculelor subțiri pe metale. 1. Când suprafața curată și strălucitoare a unei plăci de fier este încălzită la un capăt, pe ea vor apărea culori de interferență - „culori terne”. Aceasta indică apariția oxizilor de grosimi diferite. Culorile merg in urmatoarea ordine - de la capatul rece al farfurii la cel fierbinte, respectiv: galben, portocaliu, rosu, violet, violet, albastru. Când se testează proprietățile de protecție ale peliculei formate folosind picături de soluție de azotat de cupru, în locurile în care filmul are proprietăți de protecție slabe, acesta reacționează cu fierul: Cu(NO3)2 + Fe → Fe(NO3)2 + Cu. Ca urmare, cuprul va apărea la suprafață sub picături. Până la momentul după care are loc reacția, se pot aprecia proprietățile protectoare ale filmelor în diferite zone. În acest experiment, cele mai bune proprietăți de protecție se găsesc în zona care este situată departe de locul de încălzire (în spatele zonei galbene), unde suprafața rămâne neschimbată. Este evident că în această zonă există o peliculă foarte subțire, dar mai densă în comparație cu zonele încălzite. 2. Dacă rupeți un ac (sau o lamă de ras) sub mercur, se va forma amalgam în punctele rupte. Când probele sparte sunt plasate în aer în mercur, amalgamarea nu se observă. Acest lucru se explică prin formarea unui film de oxid foarte subțire, care împiedică amalgamarea. 3. Când fierul este pus într-o soluție de hidroxid de potasiu cu exces de iod, se face o zgârietură adâncă pe suprafața fierului din soluție. După ceva timp, fierul de la locul zgârieturii începe să se dizolve, iar fulgii rămân pe fundul sticlei, care la o examinare ulterioară se dovedesc a fi oxid de fier (III). Procesul de formare a peliculei pe metal are loc în etape. 16 Prima etapă a procesului de interacțiune a unui metal cu un mediu corosiv este chimisorbția agentului oxidant (O2, CO2, H2O, SO2) pe suprafața metalului, de exemplu: Me(sol) + (O2) = Me( sol) + 2Oads. În prezența afinității chimice între metal și agentul oxidant, se realizează a doua etapă de interacțiune a metalului cu mediul coroziv - trecerea filmului chimisorbit la cel de oxid. Acest proces poate fi descris în mod convențional printr-o reacție de forma: xMe(s) + yOads = MexOy. Filmul de oxid format pe suprafața metalului poate încetini procesul de coroziune datorită inhibării alimentării cu agent oxidant la suprafața metalului oxidant. În acest caz, filmul ARE PROPRIETĂȚI DE PROTECȚIE. 2.2.1. Condiție de continuitate a peliculelor pe metale Numai FILMELE CONTINUE pot avea proprietăți de protecție. Posibilitatea formării unui astfel de film este determinată de CONDIȚIA DE CONTINUITATE Pilling–Bedworth. Volumul molar al compusului care apare pe suprafața metalului (Vok) trebuie să fie mai mare decât volumul de metal (VMe) consumat pentru a forma un mol de compus: Vok/VMe >1. Dacă Vok/VMe< 1, то пленка не может быть сплошной. К металлам, не удовлетворяющим условию сплошности при окислении их кислородом, относятся щелочные и щелочно−земельные металлы. Сплошность пленок – необходимый, но недостаточный фактор, определяющий ее защитные свойства. Как показал Францевич И. Н., у пленок с Vok/VMe >>1 nu poate avea proprietăți de protecție ridicate, datorită apariției unor tensiuni interne mari în ele (de exemplu, MoO3 sau WO3). Limita superioară a raportului de volum este considerată a fi 2,5. Atunci condiția de continuitate rafinată arată astfel: 1< Vok/VMe < 2,5. 2.2.2. Законы роста оксидных пленок на металлах Процесс роста ПОРИСТОЙ ПЛЕНКИ не осложняется процессом подвода окислителя к поверхности металла, а контролируется скоростью химической реакции образования оксида. Скорость коррозии в этом случае выражается уравнением: 17 V = dx/d = kC, где x − толщина пленки; – время; k − константа скорости химической реакции образования оксида; C − концентрация окислителя на поверхности метала. Рост пористой пленки, контролируемый скоростью химической реакции окисления металла, протекает во времени ПО ЛИНЕЙНОМУ ЗАКОНУ. Линейный закон роста имеет место: − при высокотемпературном окислении на воздухе и в среде кислорода при Vok/VMe<1; − в случае образовании летучих оксидов. Сплошные пленки затрудняют проникновение реагентов друг к другу и их рост сопровождается самоторможением процесса. Результирующая скорость этого сложного процесса определяется скоростью самой медленной стадии, т.е. возможны различные варианты контроля течения процесса. 1−й вариант. Скорость коррозии контролируется стадией массопереноса (диффузионный контроль процесса). В этом случае концентрация окислителя на границе раздела Ме – оксидная пленка равна нулю, так как скорость химической реакции весьма велика. Уравнение скорости течения коррозии определяется ПАРАБОЛИЧЕСКИМ ЗАКОНОМ роста оксидной пленки. Параболический закон роста реализуется, в частности, при окислении железа на воздухе при различных температурах. 2−ой вариант. В предыдущем случае С = 0, т.е. накопление окислителя на внутренней поверхности оксидной пленки не происходит. Если учесть возможность кинетического торможения процесса роста оксидной пленки наряду с торможением на стадии массопереноса (диффузионно−кинетический контроль процесса), в этом случае приходим к СЛОЖНО − ПАРАБОЛИЧЕСКОМУ ЗАКОНУ роста оксидной пленки. Рост оксидных пленок по сложно−параболическому закону выполняется: а) при окислении железа в парах воды или в атмосфере СО2; б) при окислении Сo, Сu в атмосфере чистого кислорода; в) при частичном разрушении оксидной пленки. Рост оксидных пленок при диффузионно−кинетическом контроле может быть выражен ТАКЖЕ СТЕПЕННЫМ ЗАКОНОМ. 18 3−й вариант. Часто рост пленки протекает медленнее, чем это следует из параболического закона роста. Это наблюдается при возникновении оксидных пленок при низких температурах (на Сu в О2 при t < 100 оС; на Аl, Тi, Ni, Zn в О2 при t = 300400 оС.) Затухание объясняется либо уплотнением пленок, либо появлением дефектов (пузырей, расслоений). В этих случаях рост толщины пленки протекает в соответствии с логарифмическим законом роста: x = ln(K). 2.3. Термодинамика процесса химической коррозии В качестве примера рассмотрим процесс окисления металла в атмосфере кислорода. Процесс окисления металла может быть представлен реакцией вида: 2Ме + nО2 → Me2n+Оn. Движущая сила процесса коррозии (ДСП) может быть определена с помощью термодинамики. Торможение процесса (ТП) не может быть определено термодинамически, однако с помощью термодинамики можно оценить условия, уменьшающие или исключающие протекание процесса (применение защитных сред, катодная защита, обескислороживание и др.). Независимо от механизма коррозии возможность ее протекания определяется знаком изменения термодинамического потенциала (см. раздел 1.1). Любое изменение энергии системы характеризует переход ее в новое состояние и является мерой стабильности системы: ΔG = GII − GI , где ΔG – энергия, израсходованная на изменение состояния системы, например, на процесс коррозии; GI − энергия системы в исходном состоянии, например, металла в конкретных условиях; G II − энергия системы в новом состоянии, например, прокорродировавшего металла. Рассчитать ΔG можно, вспомнив начало химии8. Величину изобарно-изотермического потенциала можно рассчитать по разности между суммами Δ G продуктов реакции и исходных веществ: GХР = ΔG ni – ΔG mi. (прод. р-ции) (исх. в-в). ΔG - является функцией температуры. Стандартные значения для большинства веществ сведены в справочные таблицы термодинамических величин. Изменение энергии Гиббса в зависимости от температуры учитывается уравнением Гиббса. ΔG Т = ΔН 298 – 298 Δ S 298. ΔG простого вещества = 0. Определить энергию Гиббса для любой химической реакции можно по уравнению ΔG = ΔG + RТ ln К, рассчитав предварительно величину константы равновесия, например, по равновесным концентрациям веществ. При равновесии ΔG=0, поэтому ΔG+RТlnК=0, следова8 19 2.4. Кинетика процесса химической коррозии Хотя термодинамика и дает ответ на вопрос о том, насколько изучаемая система отдалена от состояния равновесия, но ответ на весьма важный практический вопрос о скорости протекания коррозионного разрушения в рамках термодинамики получен быть не может. Рассмотрением этого вопроса и занимается кинетика коррозионных процессов. 2.4.1. Скорость процесса коррозии. Показатели химической коррозии СКОРОСТЬ КОРРОЗИОННОГО процесса может быть представлена в общем виде с помощью уравнения: СКОРОСТЬ КОРРОЗИИ (СК) = ДСП / ТП, где ДСП − движущая сила процесса; ТП − торможение процесса. Скорость химической коррозии определяют количественно по наблюдениям во времени за изменением какой−либо подходящей для этих целей величины, изменяющейся в процессе коррозии. Тогда истинная скорость коррозии металлического материала определяется из выражения: V = dy/d, где y − изменяющаяся в процессе коррозии характеристика свойств материала; − время коррозии. Для количественного выражения скорости коррозионных разрушений на практике пользуются показателями коррозии, являющимися, по сути, отражением СРЕДНЕЙ СКОРОСТИ КОРРОЗИОННОГО разрушения материала: Vср=∆y/∆. Показатели коррозии. 1. ГЛУБИННЫЙ ПОКАЗАТЕЛЬ коррозии: Kn=∆П/∆, где ∆П − глубина (средняя или максимальная) коррозионного разрушения; ∆ − промежуток времени коррозии. 2. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ ТОЛЩИНЫ образующейся на металле пленки продуктов коррозии: Kn= ∆h/∆, где ∆h − изменение толщины образующейся на металле пленки продуктов коррозии. тельно, ΔG = – RТlnК. Данное уравнение позволяет также определить значение константы равновесия химической реакции по величине изобарно-изотермического потенциала. Для определения направления протекания многих химических реакций достаточно оценить знак Δ G. 1). При ΔН 0 , Δ S 0 реакция самопроизвольна (Δ G 0) при Т. 2). При ΔН 0, Δ S 0 реакция обратная (Δ G 0) при любой Т. 3). При ΔН 0, Δ S 0, реакция самопроизвольна (Δ G 0) при любой Т. 4). При ΔН 0, ΔS 0 реакция самопроизвольна (Δ G 0) при Т. 20 3. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ МАССЫ Km=∆m/S∆, где ∆m − изменение массы корродирующего металла; S – площадь поверхности коррозии. 4.ОБЪЕМНЫЙ ПОКАЗАТЕЛЬ КОРРОЗИИ Kv=∆V/S∆, где ∆V − объем газа, выделившегося или поглощенного в процессе коррозии и приведенный к нормальным условиям. 5. МЕХАНИЧЕСКИЙ ПОКАЗАТЕЛЬ КОРРОЗИИ Кs=(∆s/∆)100 %, где ∆s − относительное изменение характеристики механического свойства. 6. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ ЭЛЕКТРИЧЕСКОГО СОПРОТИВЛЕНИЯ KR=(∆R/∆)100 %, где ∆R − относительное изменение электросопротивления образца. 2.4.2. Влияние внешних факторов на химическую коррозию металлов Скорость и характер процесса химической коррозии металлов зависит от ряда факторов. ВНЕШНИМИ ФАКТОРАМИ называют те, которые связаны с составом коррозионной среды и условиями коррозии (температура, давление, скорость перемещения коррозионной среды и т.д.). Температура − мощный внешний фактор коррозии. Характер влияния температуры на скорость окисления металла определяется зависимостью константы скорости реакции окисления (k) и диффузии (D) от температуры. И k = f(T) и D = f(T) описываются одним и тем же уравнением (уравнение Аррениуса): k = k0 exp (−E/RT), (9) где k0 − константа; Е − энергия активации химической реакции. D = D0 exp (−E1/RT), (10) 1 где D0 – константа; Е − энергия активации диффузии. Таким образом, вне зависимости от вида контролирующей стадии процесса окисления с повышением температуры скорость окисления резко возрастает. Колебания температуры, особенно переменный нагрев и охлаждение, увеличивают скорость окисления металла, так как в защитной пленке образуются трещины. Состав газовой фазы. Влияние состава газовой фазы на скорость коррозии металла велико, специфично и изменяется с изменением температуры. В частности, на скорость окисления железа и 21 стали особенно сильно влияют кислород, соединения серы, водяные пары. Приведенные ниже данные свидетельствуют о зависимости увеличения относительной скорости коррозии стали с 0,17 % углерода от состава газовой фазы при 900 оС: Состав газовой фазы Кислород Чистый воздух Чистый воздух + 2 % SO2 Чистый воздух + 5 % H2O Чистый воздух + 5 % SO2+ 5 % H2O % 200 100 118 134 276 Значительное влияние на коррозию сталей и сплавов оказывают продукты горения топлива, содержащие ванадий (например, V2O5). Это соединение находится в золе от сжигания дешевого топлива − мазута, нефтепродуктов. Зола, налипая на металл, увеличивает скорость его коррозии в десятки раз. Причина этому – «ванадиевая коррозия», обусловленная легкоплавкостью V2O5, и его способностью ОФЛЮСОВЫВАТЬ (переводить в жидкое состояние) химические соединения золы и окалины. Пятиокись ванадия участвует в процессе окисления железа: 4Fe + 3V2O5 = 2Fe2O3 + 3V2O3, V2O3 + O2 = V2O5, V2O5 + Fe2O3 = 2FeVO4. Повышение содержания СО в газовой фазе понижет скорость коррозии углеродистых и низколегированных сталей, но при больших количествах СО в газовой фазе может произойти науглероживание поверхности стали. При этом возможны следующие химические реакции: 2CO + O2 = 2CO2, 2CO = Cсаж + CO2. Давление окислителя. Если бы поверхность металла не была покрыта оксидной пленкой, то скорость окисления была бы пропорциональна парциальному давлению окислителя (для двухатомных газов – PГ2). Так как поверхность металла покрыта слоем оксида, то зависимость скорости окисления от величины парциального давления окисляющего газа определяется строением защитной пленки. В то же время при окислении железа при 700 − 950о С скорость окисления не зависит от парциального давления Po2. 22 Скорость движения газовой фазы. Окисление как гетерогенный процесс определяется скоростью подвода и отвода реагентов в зону реакции. Поэтому, чем больше скорость движения потока газа, тем больше и скорость окисления металла. Режим нагрева металла. Влияние режима нагрева металла может быть рассмотрено в зависимости от влияния колебаний температуры. Иначе говоря, переменные нагрев и охлаждение увеличивают скорость окисления ввиду нарушения сохранности защитной пленки. 2.4.3. Влияние внутренних факторов на химическую коррозию металлов ВНУТРЕННИМИ называют факторы, связанные с составом, структурой, внутренними напряжениями в металле, качеством обработки поверхности металла и др. Состав сплава. Применительно к наиболее важным конструкционным сплавам на основе железа для случая газовой коррозии можно отметить следующее. 1. При высоких температурах (более 800оС) с увеличением содержания углерода в стали скорость ее окисления и обезуглероживания уменьшается вследствие более активного образования СО, что снижает окислительный потенциал газовой фазы. 2. Сера фосфор, никель, марганец практически не влияют на скорость окисления железа. 3.Титан, медь, кобальт, бериллий заметно снижают скорость окисления железа. 4. Хром, алюминий, кремний сильно замедляют окисление железа. 5. Ванадий, вольфрам и молибден могут значительно ускорить окисление стали, которое иногда носит катастрофический характер. Структура сплава. Анализ экспериментальных данных свидетельствует о том, что чем меньше в сплаве структурных составляющих, тем выше его жаростойкость. Применительно к сплавам железо – углерод наиболее устойчивой является АУСТЕНИТНАЯ СТРУКТУРА9. Аустенит (γ-фаза) − высокотемпературная гранецентрированная модификация железа и его сплавов. В углеродистых сталях аустенит − это твѐрдый раствор внедрения, в котором атомы углерода входят внутрь элементарной ячейки γ-железа во время конечной термообработки. В сталях, содержащих другие металлы (кроме железа, легированные стали), атомы металлов замещают атомы железа в кристаллической решетке, и возникает твердый раствор замещения. Фаза названа в честь сэра Уильяма Чандлера Робертс-Остина (англ. William Chandler Roberts-Austen, 1843 − 1902). 9 23 Всего различают пять больших групп нержавеющих сталей, определяемых их микроструктурой. Наиболее распространенными являются три: АУСТЕТНИТНЫЕ (AUSTENITIC) − не магнитная сталь с основными составляющими 15−20 % хрома и 5−15 % никеля, который увеличивает сопротивление коррозии. Она хорошо подвергается тепловой обработке и сварке. Обозначается буквой A в начале наименования марки. Именно аустенитная группа сталей наиболее широко используется в промышленности и в производстве элементов крепежа. МАРТЕНСИТНЫЕ (MARTENSITIC) − значительно более твердые, чем аустетнитные стали и могут быть магнитными. Они упрочняются, закалкой и отпуском подобно простым углеродистым сталям и находят применение главным образом в изготовлении столовых приборов, режущих инструментов и общем машиностроении. Больше подвержены коррозии. Обозначаются буквой С. ФЕРРИТНЫЕ (FERRITIC) стали значительно более мягкие чем мартенситные по причине малого содержания углерода. Они также обладают магнитными свойствами. Обозначаются буквой F. Стали с двухфазной АУСТЕНИТНО−ФЕРРИТНОЙ СТРУКТУРОЙ менее устойчивы против окисления. Их меньшая жаростойкость связывается с большей неоднородностью образующейся защитной пленки, что приводит к ее разрушению при росте (неоднородность возникающих внутренних напряжений). Так хромоникелевые стали с однофазной аустенитной структурой более устойчивы против окисления, чем двухфазные: Х12Н12М2Т, Х12Н9Т ведут себя лучше, чем ОХ21Н5МД2Т или 1Х21Н5Т 2]. На жаростойкость10 чугунов кроме их состава влияет и структура. Существенное влияние оказывает форма графитных включений. Так, при шаровидной форме графита стойкость против окисления выше, чем при пластинчатой. Установлено, что предварительная холодная пластичная деформация несколько ускоряет окисление металла вследствие повышения запаса его энергии. Чем тщательнее обработана поверхность металла, тем меньше скорость его окислеЖаростойкость − окалиностойкость, способность металлических материалов противостоять химическому разрушению поверхности под воздействием воздушной или иных газообразных сред при высоких температурах. 10 24 ния, что обусловлено лучшей сохранностью защитных пленок на гладкой поверхности. 2.5. Некоторые случаи газовой коррозии металлов в технологических средах В химической промышленности многие технологические процессы или их определенные стадии протекают в газовой среде в условиях повышенных температур и давлений (рис.4). При температурах от 100 до 200 − 300 °С многие газы не опасны. Химическая активность газов и скорость газовой коррозии металлов сильно возрастают при температурах выше 200 − 300 °С. Так, Cl2 начинает действовать на железные сплавы при Рис. 4. Некоторые случаи газовой температуре > 200 °C, HCl - > coroziunea metalelor în tehnologic - 300 °C, SO2, NO2, vapori de sulf. > 500 °C. Aceste caracteristici ale comportamentului mediilor tehnologice ale gazelor și utilizarea lor pe scară largă în industrie necesită o analiză mai detaliată a comportării metalelor în condiții reale. 2.5.1. Coroziunea fierului, fontei și oțelurilor într-o atmosferă de vapori de O2, CO2, H2O Impactul oxigenului din aer la temperaturi ridicate asupra aliajelor fier-carbon duce la oxidarea fierului cu formarea calcarului, decarburarea oțelului și creșterea. din fontă. Ca urmare a oxidării fierului la temperaturi ridicate, se formează un strat de produse de coroziune numit SCALA. Scala are o structură complexă și include mai mulți oxizi: Fe3O4 – MAGNETIT are o rețea cristalină complexă de spinel; Fe2O3 – HEMATIT are o rețea romboedrică; FeO – VUSTIT are o structură de rețea cristalină defectuoasă. Wustitul se formează la temperaturi peste 575 oC și se descompune la răcire lentă: 4FeO Fe3O4 + Fe. 25 Sub 575 °C nu există wustită în scară și un strat de Fe3O4 este direct adiacent suprafeței de oțel. Viteza de oxidare a oțelului (vezi Secțiunea 2.4.1) crește odată cu creșterea temperaturii conform unei legi apropiate de exponențial (Fig. 5), iar în coordonate logk − 1/T este exprimată printr-o linie întreruptă, fiecare întrerupere a cărei rupere corespunde cu oarecare transformare. Astfel, la o temperatură de 575 ºC, în scară apare un substrat de wustite FeO, care nu interferează cu difuzia oxigenului, drept urmare energia de activare a procesului crește și viteza de oxidare a metalului crește. Ruperea curbei la o temperatură de ~ 900 ºС corespunde transformării alotropice a oțelului. Natura modificării dependenței de temperatură a vitezei de oxidare a oțelului indică faptul că structura austenitică este mai rezistentă la căldură, în care se observă o creștere mai lentă a vitezei de oxidare odată cu creșterea temperaturii. Odată cu oxidarea în oțeluri și fontă, are loc procesul de decarbonizare - epuizarea stratului superficial în carbon datorită interacțiunii carburii de fier conținute în acestea cu oxigenul și reactivii care conțin oxigen Fe3C+O2→3Fe+CO2 Fe3C+CO2 →3Fe+2CO Fe3C+H2O→3Fe+CO + H2. 26 Compoziția mediului gazos are o influență puternică asupra vitezei de oxidare a oțelului și a fontei. În coroziunea gazoasă, agenții agresivi pot fi, de exemplu, clorul, compușii cu sulf, oxigenul, aerul, compușii cu iod etc. Agresivitatea lor față de diferite metale nu este aceeași, prin urmare, viteza de coroziune variază. Astfel, viteza de oxidare a Fe, Co, Ni la o temperatură de 900 °C crește în ordinea H2O → CO2 → O2 → SO2. În acest caz, metalele, în funcție de viteza de coroziune din atmosfera acestor reactivi, sunt dispuse în serie ascendentă: Ni → Co → Fe. Dacă presupunem că rata de coroziune în aer la 900 °C este de 100%, atunci adăugarea a 2% SO2 crește această rată la 118%, 5% H2O la 134%, 2% SO2 + 5% H2O la 276%. 2.5.2. Coroziunea sub influența produselor de ardere a combustibilului Produsele de ardere a combustibilului (cărbune, păcură etc.) conțin în majoritatea cazurilor cantități semnificative de compuși ai sulfului (SO2, H2S) și vanadiu sub formă de V2O5, care este un agent oxidant puternic. Oxidul de vanadiu cu punct de topire scăzut interacționează cu stratul protector de calcar de pe suprafața metalului, distrugându-l și formând vanadați, care creează eutectice11 cu punct de topire scăzut Fe2O3 + V2O5 → 2FeVO4 cu oxid de vanadiu V2O5. Astfel, vanadatul de fier (FeVO4) are punctul de topire = 840 °C, iar punctul de topire al eutecticului său cu V2O5 este de 625 °C; Punctul de topire al vanadatului de crom CrVO4 este de 810 °C, iar eutectica sa cu V2O5 este de 665 °C. Apoi, vanadatul participă activ la procesul de oxidare al metalului însuși 6FeVO4+4Fe→ 5Fe2O3 + 3V2O3 4Fe+ 3V2O5→ 2Fe2O3 + 3V2O3 V2O3+O2→ V2O5, iar V2O5 în sine nu este practic consumat. În cea mai mare măsură, coroziunea vanadiului afectează bobinele cuptorului, suporturile și partițiile care funcționează în intervalul de temperatură de 620 – 700 °C. Eutectic (din grecescul éutektos - se topește ușor), un sistem lichid (soluție sau topitură) care se află la o presiune dată în echilibru cu fazele solide, al căror număr este egal cu numărul de componente ale sistemului. 11 27 În același timp, viteza de coroziune chiar și a oțelurilor crom și crom-nichel, care nu sunt predispuse la coroziune cu hidrogen sulfurat la temperatură înaltă, ajunge la 15 mm/an. Sub influența compușilor cu sulf, oțelurile fier-carbon sunt supuse unei coroziuni intergranulare intense din cauza unui număr mai mare de defecte în rețelele cristaline ale sulfurilor decât oxizilor. Aceasta duce la intensificarea proceselor de difuzie. Odată cu creșterea conținutului de monoxid de carbon (II) în produsele de ardere, viteza de coroziune a gazelor a oțelurilor carbon și slab aliate scade considerabil. Cu toate acestea, concentrația sa foarte mare duce la carburarea suprafeței: 3Fe+2CO→Fe3С+CO2. Aliajele puternic aliate de tip X40N50 sunt rezistente la coroziunea vanadiului. Introducerea siliciului în oțel are, de asemenea, un efect pozitiv, aliarea oțelului cu molibden, wolfram și vanadiu are un efect negativ asupra durabilității oțelului, deoarece aceste elemente de aliere favorizează formarea V2O5. Aliajele pe bază de Cu sunt foarte susceptibile la o astfel de coroziune. Pentru reducerea vitezei de coroziune a vanadiului se utilizează în prezent următoarele: − limitarea temperaturii de funcţionare la 650 °C; − utilizarea aliajelor de tip X40N50 pentru fabricarea componentelor supuse acestui tip de distrugere; − suflarea în combustibil a prafului de dolomit ce conţine oxizi de magneziu şi aluminiu, care formează compuşi refractari cu oxidul de vanadiu; − limitarea conținutului total de sodiu și vanadiu în combustibil la cel mult 2 10–4%. 2.5.3. Coroziunea în mediul clorului și clorurii de hidrogen Comportarea metalelor în mediul clorului gazos și clorurii de hidrogen este fundamental diferită de acțiunea altor medii agresive. Acest lucru se datorează faptului că sărurile clorurate care se formează la suprafața metalului au un punct de topire scăzut, iar în unele cazuri, când temperatura crește, se sublimă13, de exemplu Ti + 2Cl2 → TiCl4. Promovare - (sinonime) conducere, promovare, regie. Sublimarea este trecerea unei substanțe de la starea solidă la starea gazoasă, ocolind faza lichidă; la fel ca sublimarea. 12 13 28 Majoritatea acestor reacții sunt exoterme. Viteza de îndepărtare a căldurii se dovedește a fi mai mică decât viteza reacției în sine, ca urmare a căreia metalele se aprind și „ard” într-o atmosferă de clor. Acest lucru duce la o creștere locală semnificativă a temperaturii, iar clorurile rezultate se topesc și se descompun. Cele mai rezistente la clor sunt otelurile cu nichel, plumb si crom. Temperatura de aprindere a unor metale într-o atmosferă de clor uscat: o t aprindere. Cu Ti< 20 Pb 90−100 Fe 150 Cu 200 Ni > 500. În acid clorhidric uscat la temperatura camerei, un număr de metale și aliaje au rezistență satisfăcătoare. Odată cu creșterea temperaturii, rezistența materialelor metalice scade treptat până la o temperatură specifică fiecărui metal. Temperaturile maxime ridicate admise în timpul funcționării pe termen lung a metalelor și aliajelor în clor uscat și clorură de hidrogen sunt date în tabel. 2. Cele mai rezistente metale din clorul uscat, cu excepția metalelor nobile, sunt nichelul și aliajele acestuia. Filmele de suprafață formate pe oțeluri nichel și crom-nichel au volatilitate scăzută și proprietăți de protecție satisfăcătoare. Tabelul 2 Temperaturi admisibile la operarea unor metale și aliaje într-o atmosferă de acid clorhidric și clor3] T, °C Material Cl2 1200 − − 550 − 100 150 300 − Platină Aur Tungsten Nichel Inconel (80% Ni, 14% Cr, 6% Fe) Cupru Oţel carbon St.Z Oţel inoxidabil 12Х18Н9Т Argint 29 HCl 1200 870 600 510−600 480 100−120 260−350 450−500 230 2.5.4. Coroziunea oțelului cu hidrogen Coroziunea cu hidrogen poate însoți multe procese tehnologice care au loc la temperaturi ridicate de la 200°C și presiuni de la 300 MPa în medii care conțin hidrogen. Aceste condiții corespund unor procese precum hidrogenarea cărbunelui și petrolului, sinteza amoniacului și a metanolului etc. Se observă două tipuri de deteriorare a metalelor de către hidrogen - HYDROGEN BRRITTLESS și HYDROGEN CORROSION. Adesea, aceste fenomene se suprapun. Dacă amoniacul este prezent în gaz, atunci poate apărea și NITRIDAREA METALULUI. Când un amestec de azot-hidrogen intră în contact cu un metal în condiții de temperatură și presiune ridicate, hidrogenul molecular se disociază pe suprafața metalului. Hidrogenul atomic rezultat difuzează în rețeaua metalică și se dizolvă în ea. Pe măsură ce temperatura scade din cauza solubilității scăzute, hidrogenul tinde să intre în stare gazoasă în interiorul metalului. În acest caz, în metal apar tensiuni mari, ducând la fragilitate ireversibilă. Coroziunea hidrogenului este rezultatul interacțiunii chimice a hidrogenului cu componenta carbură a oțelului. În exterior, manifestarea coroziunii cu hidrogen înseamnă o scădere puternică a rezistenței oțelului fără distrugerea vizibilă a suprafeței. Mecanismul coroziunii hidrogenului cuprinde următoarele etape: - la temperaturi ridicate, hidrogenul molecular se disociază în atomi care sunt absorbiți de suprafața oțelului și difuzează în rețeaua sa cristalină; − fiind un agent reducător activ, hidrogenul atomic reduce carbura de fier și interacționează cu carbonul dizolvat în oțel prin reacții ireversibile: Fe3C + 2H2 3Fe + CH4 C + 4H CH4, privând astfel oțelul de baza sa de întărire. Deoarece procesele de difuzie, inclusiv mișcarea hidrogenului, se realizează cel mai ușor de-a lungul granițelor de cereale, unde plăcile de cementită sunt localizate predominant, distrugerea lor de către hidrogen duce la o întrerupere a conexiunii dintre cristalite și, în consecință, la o scădere a ductilității oțelului. . 30 Metanul rezultat are o dimensiune moleculară mare în comparație cu parametrii rețelei cristaline de ferită. Ca urmare, nu poate difuza din cea mai mare parte a metalului și se acumulează în microcavitățile și defectele sale, provocând o presiune mare în interiorul cavității și ducând la fisurare. În acest caz, crăpăturile se dezvoltă de-a lungul limitelor de cereale. În oțelurile blânde cu proprietăți de rezistență scăzute, acumulările de metan apar predominant în stratul apropiat de suprafață, formând umflături care sunt clar vizibile pe suprafața oțelului. Pe lângă participarea la formarea metanului, hidrogenul are o solubilitate bună în metal. Concentrația de hidrogen dizolvat în metal depinde de presiunea parțială a hidrogenului la interfața metal-gaz și poate fi determinată prin formula: = Ks p1/2, unde este cantitatea de hidrogen dizolvat în oțel, cm3/ 100g; p – presiunea parțială a hidrogenului, la; Ks – solubilitatea hidrogenului în oțel la p = 1 at. Deoarece dizolvarea hidrogenului de către un metal este un proces endotermic, solubilitatea hidrogenului crește odată cu creșterea temperaturii. Acest fenomen se numește PERMEABILITATE LA HIDROGEN (VH) 4]. Permeabilitatea la hidrogen a oțelului depinde de conținutul de carbon și de elemente de aliere din acesta și scade odată cu creșterea conținutului de carbon, după cum reiese din datele din tabel. 3. Tabelul 3 Efectul conținutului de carbon asupra permeabilității la hidrogen a oțelurilor carbon Metal C, % în greutate VН, cm3/cm2h mm–1 Fier tehnic 0,04 5,10 Oțel 15 0,15 4,09 Oțel 30 0,27 2,79 Oțel U10A 1,10 2,24 Hidrogen nu apare coroziunea imediat din momentul în care oțelul este expus la hidrogen, dar după o anumită perioadă de timp. Acest timp, în care nu au loc modificări ale microstructurii și proprietăților mecanice ale oțelului, se numește PERIOADA DE INCUBARE A PROCESULUI DE DECARBARE A OȚELULUI. 31 Perioada de incubație este de mare importanță practică, deoarece determină în esență timpul de funcționare în siguranță a echipamentului. Perioada de incubație depinde în principal de temperatură și presiune. Odată cu creșterea temperaturii și presiunii, perioada de incubație scade. În același timp, durata perioadei de incubație este foarte influențată de compoziția chimică a oțelului. Temperatura și presiunea parțială a hidrogenului afectează nu numai durata perioadei de incubare, ci și viteza de decarburare a oțelului în timpul coroziunii cu hidrogen. 2.5.5. Coroziunea carbonil Coroziunea carbonil apare în procesele tehnologice care implică carbon la presiuni și temperaturi ridicate. Astfel de procedee includ, de exemplu, producerea de alcooli metilici și butilici, transformarea metanului și a monoxidului de carbon. În condiții normale, CO este inert față de metale. La temperaturi și presiuni ridicate, monoxidul de carbon reacționează cu multe metale și formează carbonili. De exemplu Fe + nCO = Fe(CO)n. Fierul și CO pot forma trei compuși: tetracarbonil - Fe(CO)4, pentacarbonil - Fe(CO)5 și nanocarbonil - Fe(CO)g. Toți acești compuși sunt destul de instabili și se descompun atunci când temperatura crește. Cel mai stabil compus dintre ele este Fe(CO)5. Formarea carbonililor crește odată cu creșterea temperaturii de la 100 ºС, apoi, în intervalul de temperatură 140 – 180 ºС, se observă disocierea lor aproape completă în Fe și CO. Monoxidul de carbon (II) poate forma compuși similari cu multe alte metale. Coroziunea carbonil provoacă distrugerea și slăbirea stratului de suprafață de metal la o adâncime de 5 mm. Modificări ale structurii metalului la o distanță mai mare de suprafață nu mai apar. 2.5.6. Coroziunea în non-electroliți NEELECTROLIȚII sunt lichide care nu conduc electricitatea. Medii corozive lichide de origine anorganică - brom lichid, sulf topit etc. Substanțe organice lichide - benzen, cloroform etc., combustibil lichid (ulei, kerosen, benzină etc.), uleiuri lubrifiante. În forma lor pură, sunt slab agresivi, totuși, prezența în ele chiar și a unor cantități mici de impurități (mercaptani14, hidrogen sulfurat, apă, oxigen etc.) le crește brusc activitatea chimică. Astfel, mercaptanii și hidrogenul sulfurat conținute în țiței provoacă coroziunea Fe, Cu, Ni, Ag, Pb, Sn cu formarea mercaptidelor lor (Me−(S−R)n) și respectiv polisulfurilor (Me2Sx). Urmele de apă din tetraclorura de carbon cresc corozivitatea acesteia datorită formării componentelor conductoare (HCl) ca urmare a hidrolizei și apariției coroziunii prin mecanismul electrochimic: CCl4 + H2O → COCl2 + 2HCl CCl4 + 2H2O + kаt → CO2 + 4HCl În principal, coroziunea metalelor din non-electroliți are loc printr-un mecanism chimic. Acest proces constă din mai multe etape, fiecare dintre acestea determinând viteza de coroziune: 1) difuzia oxidantului pe suprafața metalului; 2) chimisorbția agentului de oxidare; 3) reacție chimică; 4) desorbția produselor de coroziune de pe suprafața metalului; 5) difuzia produselor de coroziune în volumul non-electrolitului. În unele cazuri, pe o suprafață metalică se formează o peliculă de protecție din produsele de coroziune, ceea ce duce la inhibarea procesului de coroziune din cauza dificultății de difuzare a oxidantului pe suprafața metalului. În funcție de proprietățile de protecție ale filmului rezultat și de solubilitatea acestuia, se poate instala controlul difuziei, cinetic sau mixt difuzie-cinetic al procesului. Temperatura afectează în mod semnificativ viteza de coroziune chimică a metalelor în non-electroliți (vezi secțiunea 2.4.). Efectul temperaturii asupra vitezei procesului este în unele cazuri complicat de modificările solubilității oxidantului și ale filmului de produse metalice de coroziune în non-electrolit atunci când temperatura se schimbă. 14 Mercaptanii sunt derivați hidrosulfurați ai hidrocarburilor: R – S –H. 33 Prezența apei în neelectroliți activează în mod semnificativ efectul coroziv al impurităților și provoacă coroziune electrochimică intensă a metalelor, de exemplu. mecanismul procesului de coroziune se modifică. Pentru a proteja metalele din non-electroliți de coroziunea chimică, se selectează metale și aliaje care sunt stabile într-un mediu dat (de exemplu, aluminiul și aliajele sale sunt stabile în benzina crăpată) și se aplică acoperiri de protecție (de exemplu, oțel într-un mediul de hidrogen sulfurat este acoperit cu aluminiu). 2.6. Metode de protejare a metalelor de diferite tipuri de coroziune gazoasă 2.6.1. Metode de protejare a oțelului împotriva coroziunii cu gaz Pentru a proteja oțelul împotriva coroziunii cu gaze, cele mai utilizate sunt cele mai utilizate ALIOARE rezistente la căldură și ACOPERURI DE PROTECȚIE. Aliere - (germană legieren - „a fuziona”, din latină ligare - „a lega”) - adăugarea de impurități în compoziția materialelor pentru a schimba (îmbunătăți) proprietățile fizice și/sau chimice ale materialului de bază. Principalele metode de protejare a metalelor de oxidare la temperaturi ridicate se bazează pe ALIAREA. Rezistența metalelor oxidate la temperaturi ridicate depinde de proprietățile protectoare ale peliculei de oxid care acoperă metalul. Elementele care contribuie la crearea unui strat protector pe aliajele fier-carbon sunt cromul, aluminiul și siliciul. Aceste elemente se oxidează mai ușor la temperaturi ridicate în aer decât metalul aliat și formează o scară mai stabilă. Conform teoriei aliajului termorezistent, componenta de aliere formează pe suprafața metalică un strat protector format numai din oxidul componentei de aliere. Elementul de aliere trebuie să îndeplinească următoarele cerințe de bază: Oxidul format pe suprafața metalului trebuie să fie continuu, adică. raportul Vok/VMe trebuie să fie >1. Stratul de oxid trebuie să aibă o rezistență ohmică mare rMeO > rFe, dimensiunea ionilor componente de aliere trebuie să fie mai mică decât dimensiunea ionilor de metal de bază, adică. rMe< rFe. Это условие вытекает из следующих соображений: 34 а) меньший радиус иона легирующего компонента по сравнению с ионом основного металла позволяет предполагать у легирующего компонента больший коэффициент диффузии в сплаве, что может обеспечить преимущественный выход ионов компонента на поверхность сплава и, следовательно, преимущественное образование оксида легирующего компонента; б) меньший радиус иона легирующего компонента позволит образовать оксид с соответствующими меньшими параметрами, который будет оказывать большое сопротивление диффузии через него и, следовательно, создавать большое затруднение для окисления основного металла. Это подтверждается сравнением размеров ионных радиусов железа и легирующих элементов: хрома, алюминия и кремния Ион металла Ионный радиус, Аº Fe2+ 0,74 Cr6+ 0,52 Al3+ 0,50 Si4+ 0,41. А энергия образования оксида легирующего компонента должна быть больше энергии образования оксида основного металла ΔGMeO<ΔGFeO. Если это условие не соблюдается, то оксид легирующего компонента будет восстанавливаться основным компонентом, как например, оксидная пленка меди, которая не может быть устойчивой на железном сплаве вследствие возможности протекания реакции CuO+Fe → FeO+Cu. При этом необходимо соблюдение условий: высокая температура плавления оксида легирующего компонента, низкая упругость диссоциации, а также отсутствие низкоплавких эвтектик в смеси с другими оксидами для того, чтобы оксид легирующего компонента был достаточно устойчив. В качестве примера можно привести элемент бор, который является аналогом Al по таблице Менделеева, но дает легкоплавкие оксиды. Температура плавления ВО3 − 294 0С, и поэтому бор, в отличие от алюминия, не может быть легирующим компонентом, повышающим жаростойкость. Необходимым условием является также, образование твердых растворов между легирующими компонентами и основным металлом, так как при этом условии возможно равномерное распределение этого элемента на поверхности и образование сплошной пленки оксида легирующего компонента. 35 Существует и другая теория, согласно которой легирующий элемент образует на поверхности сплава смешанные оксиды, обладающие повышенными защитными свойствами, по сравнению с оксидами чистых компонентов. Механизм повышения жаростойкости можно свести к тому, что легирующий компонент должен уменьшить возможность образования в окалине вюститной фазы (FeO) на стали и, таким образом, благоприятствовать образованию шпинельной фазы типа Fe3O4ּγFe2O3 с возможно меньшим параметром решетки. Жаростойкие легированные стали имеют на поверхности оксидные слои со структурой именно шпинели. Еще более высокими защитными свойствами обладают сложные шпинели типа FeOּMe2O3 или Fe2O3 ּMeO. С целью экономии легированных сталей жаростойкость углеродистых сталей повышают, применяя защитные покрытия. Для нанесения на сталь защитных покрытий пользуются следующими методами: ТЕРМОДИФФУЗИОННЫМ, НАПЛАВКОЙ И ПЛАКИРОВАНИЕМ. Для нанесения покрытий термодиффузионным методом стальное изделие после очистки поверхности механическим способом и травлением помещают в реакционную смесь, состоящую из порошка наносимого металла и катализатора. Например, при нанесении алюминиевых покрытий смесь содержит измельченный ферроалюминиевый и хлористый аммоний. Процесс насыщения поверхности стали алюминием (АЛИТИРОВАНИЕ) производится при высоких температурах (900−9500С), в результате чего происходит разложение хлористого аммония на аммиак и хлористый водород: NH4Cl → NH3 + HCl, который, в свою очередь, взаимодействует с алюминием 2Al +6HCl → 3H2 + 2AlCl3. На поверхности стального изделия происходит выделение атомарного алюминия AlCl3 +Fe → FeCl3 + Al, который диффундирует в сталь. Значительное повышение жаростойкости стали термодиффузионным покрытием обусловлено образованием окислов Al2O3 или двойных окислов FeAl2O4 в алитированном слое. На поверхности хромированных или силицированных изделий образуются соответствующие оксиды хрома или кремния. 36 НАПЛАВКА − это нанесение слоя металла или сплава на поверх- ность изделия посредством сварки плавлением. ПЛАКИРОВА́НИЕ − (фр. plaquer − накладывать, покрывать) термомеханическое покрытие − нанесение на поверхность металлических листов, плит, проволоки, труб тонкого слоя другого металла или сплава термомеханическим способом. Для защиты от карбонильной коррозии применяют хромистые стали с содержанием 30 % Сг, хромоникелевые стали с содержанием 23 % Сг и 20 % № и марганцевые бронзы доя работы при температуре до 700 °С и давлении до 35 МПа. При более низких параметрах возможно применение менее легированных сталей типа Х18Н9. Сырьем для синтеза мочевины CO(NH2)2 является NH3 и СО2. Процесс протекает при температуре 175−190°С и давлении 20 МПа. Хромистые нержавеющие стали различных марок непригодны для изготовления основных аппаратов. Наибольшую стойкость имеют стали, легированные молибденом, и хромникельмолибденовомедные стали. Важным фактором для повышения коррозионной устойчивости является тщательная очистка газов от сероводорода и дополнительное введение в систему кислорода в количестве 0,5- 1,0 об.% от содержания СО2. При сернистой коррозии сера и ее соединения - сернистый ангидрид (SO2), сероводород (H2S), меркаптаны или тиоспирты и т.д. являются достаточно агрессивными, коррозионно−активными веществами. Наиболее активным компонентом при высокотемпературной газовой коррозии является сероводород. Он даже более опасен, чем диоксид серы. Сернистый газ SO2 является исходным продуктом при производстве серной кислоты. Его получают при обжиге серного колчедана, сжигании серы, из сероводорода при утилизации отходящих газов металлургических производств. Чугунные детали скребков конверторных печей кипящего слоя, зубья и гребки колчеданных печей, котлы−утилизаторы, сухие электрофильтры, газоходы обжиговых газов в производстве серной кислоты часто выходят из строя вследствие газовой коррозии. В результате коррозии черных металлов в сернистом газе при температурах 300°С и выше образуется слоистая окалина, состоящая из FeS, FeO и др. 37 При температуре газа более 400 °С для деталей из чугуна характерно увеличение объема металла, достигающего 10 % от начальной величины. При этом резко снижается прочность материала. Детали испытывают коробление, трескаются и разрушаются. Это явление называется «ростом» чугуна и объясняется внутренним окислением металла. Максимальный рост чугуна наблюдается при 700 °С. К ростоустойчивым чугунам относятся высоколегированные хромистые чугуны, карбидный чугун типа «пирофераль» и «чугаль» Сернистый газ при высоких температурах окисляет никель. При этом образуется окалина, в состав которой входят NiS и NiO: 3Ni + S02 = NiS + 2NiO. Сернистый никель образуется и при действии на металл сероводорода: Ni + H2S = NiS + Н2. Сульфид никеля с металлическим никелем образует легкоплавкую эвтектику с температурой плавления около 625 °С. Образование этой эвтектики в сталях, содержащих никель, происходит преимущественно по границам зерен, вызывая разрушение металла. Стали с содержанием никеля выше 15 % очень чувствительны к действию сернистого газа. В процессе окисления они теряют механическую прочность. Поэтому при работе с газовой средой, содержащей диоксид серы, при температурах до 400 °С используют углеродистые стали, а при более высоких температурах − хромистые стали. Наиболее употребительны жаростойкие стали − 4Х9СА, Х6СЮ, XI7, ОХ 17 Г, X1800, Х25Т. Интенсивное образование окалины происходит при температурах выше 800−1000 °С. К жаропрочным сталям в этой среде относятся Х5М, Х6СМ, XI8Н12Т, Х23Н18. Рабочая температура для этих сплавов 550−600 °С (для Х23Н18 − 1000 °С). Сухой сернистый газ реагирует с алюминием очень медленно. Поэтому алюминий используют для защиты от коррозии деталей и узлов теплообменников и контактных аппаратов. Сухой сероводород при комнатной температуре не представляет опасности для обычных углеродистых сталей. С повышением температуры опасность сероводородной коррозии углеродистых сталей значительно увеличивается. При температуре выше 300 °С 38 железо подвергается сильной коррозии в серосодержащих газовых средах. Легирование хромом в количестве > 12% mărește rezistența la coroziune la temperaturi de până la 700-800 °C. Când oțelurile cu crom se corodează, se formează calcar, al cărui strat exterior constă din sulfură de fier. Practic nu există crom în acest strat. Tot cromul oxidat este concentrat în stratul interior, care are o proprietate protectoare. Feritice Fig. 5 10 15 20 au o rezistență chimică bună într-o atmosferă de sulf-Cr, % în greutate hidrogen. 6. Viteza de coroziune a aliajelor de crom care conțin 25–30% oțel solid în vapori de ulei la 650 °C. Numerele de pe curbe indică crom. Conținut de H2S, % Deosebit de periculoasă este prezența combinată a compușilor de sulf și a altor componente corozive. Astfel, în industria petrolului, în timpul prelucrării termice a uleiurilor sulfuroase, un amestec de hidrogen sulfurat și hidrogen prezintă un pericol deosebit. Din cele prezentate în Fig. Datele 6 arată că viteza de coroziune a oțelurilor cu crom crește odată cu creșterea concentrației de hidrogen sulfurat în vaporii de ulei. În acest caz, o creștere a concentrației de H2S de 10 ori determină o creștere a ratei de coroziune de peste 12-15 ori. Când combustibilul arde, se formează amestecuri complexe de gaze care conțin O2 și diverși oxizi, inclusiv impurități de sulf. În aceste cazuri se observă coroziune SULFID-OXIDĂ. Filmul de protecție pe metal constă de obicei din mai multe straturi. Stratul exterior este îmbogățit cu oxigen și este format din oxid metalic, iar straturile interioare adiacente suprafeței metalice conțin cantități crescute de sulf și sulfuri. Dacă arderea combustibilului produce cenușă, care conține oxid de vanadiu V2O5, atunci viteza de coroziune crește foarte repede. Cauzele coroziunii cu vanadiu a otelurilor au fost discutate mai devreme (vezi sectiunea 2.5.2). 39 Oțelurile cu crom care conțin 4−6% Cr sunt considerate semirezistente la căldură. Oțelurile din această clasă, datorită disponibilității lor, rezistenței crescute la coroziune și rezistenței, sunt utilizate pe scară largă în industria petrolului pentru fabricarea unităților de cracare. Rezistența la căldură a acestor oțeluri în aer și în gazele de ardere cu un conținut semnificativ de compuși de sulf la temperaturi de 500-600 ºС este de aproximativ 3 ori mai mare decât rezistența la căldură a oțelurilor nealiate. 2.6.2. Metode de protecție împotriva coroziunii hidrogenului Una dintre principalele modalități de creștere a rezistenței la hidrogen a oțelurilor este ALIAREA acestora cu elemente puternice care formează carburi, care formează carburi mai stabile decât cementita. Astfel de elemente sunt crom, wolfram, molibden, vanadiu, niobiu, titan. Tipul de fază de carbură are o mare influență asupra rezistenței la hidrogen a oțelului. În oțelurile aliate cu crom, rezistența la hidrogen scade în funcție de compoziția fazei de carbură în următoarele serii: (Cr,Fe)23C6(Cr,Fe)23C6 + (Cr,Fe)7C3(Cr,Fe) 7C3 (Cr,Fe)7C3 + (Fe,Cr)3C(Fe,Cr)3C Seria de mai sus arată că cea mai mare rezistență la hidrogen în oțelurile cu crom este obținută prin formarea carburilor de (Cr,Fe). )23C6 tip. Formarea acestui tip de carbură cu un conținut de carbon în oțel de 0,05% are loc atunci când în oțel există cel puțin 6% crom, iar la creșterea conținutului de carbon este necesară o creștere a conținutului de crom. La alierea oțelului cu elemente care formează carburi mai puternice decât cromul, cea mai mare rezistență la hidrogen a oțelului este obținută atunci când aceste elemente sunt conținute în cantități suficiente pentru a lega tot carbonul în carburi de tip MeC. În cazurile în care elementele echipamentelor funcționează în condiții de niveluri ridicate de sarcini mecanice, oțelurile rezistente la hidrogen trebuie să aibă și rezistență la căldură. Pentru aceste condiții, se folosesc oțeluri cu 3% Cr, aliate suplimentar cu Mo, V sau W, de exemplu oțel de calitate 20Х3МВФ (EI579). Calitățile de oțel X5M, X5VF, X9M, 1X13 au o rezistență și mai mare. În cele mai severe condiții, se folosesc oțeluri austetice crom-nichel rezistente la căldură 0Х18Н10Т sau Х17Н17М2Т. 40 O altă metodă utilizată pe scară largă de creștere a rezistenței la hidrogen a oțelurilor este PLACAREA acestora cu metale care au o permeabilitate la hidrogen mai mică decât metalul de bază. Acest lucru face posibilă reducerea concentrației de hidrogen la interfața dintre metalul de bază și stratul de placare și reducerea efectului său agresiv asupra metalului de bază. Calculul presiunii efective a hidrogenului la interfața metal de bază-acoperire se realizează conform ecuației: 1/2 1/2 p2 = p1 (11) + unde p1 este presiunea hidrogenului pe suprafața exterioară a strat de placare; p2 este presiunea efectivă a hidrogenului la interfața acoperire-metal de bază; = VН1/VН2 este raportul dintre permeabilitatea la hidrogen a stratului de placare și respectiv a metalului de bază; = l1/l2 – raportul dintre grosimea stratului de placare și respectiv a metalului de bază. În ordinea creșterii permeabilității la hidrogen, metalele și aliajele pot fi aranjate pe rând: aluminiu, cupru, nichel, X18N10T, 0X13. În practică, industria chimică și de rafinare a petrolului utilizează în principal bimetale din oțeluri carbon sau slab aliate cu un strat protector de oțeluri 0Х13 sau Х18Н10Т. Temperatura de funcționare a echipamentelor fabricate din oțel selectat trebuie menținută cu 25°C sub cea la care este posibilă coroziunea cu hidrogen. Capitolul 3. COROZIA ELECTROCHIMICĂ A METALELOR 3.1. Potențialul electrod al metalelor Când un metal este scufundat într-un electrolit, are loc un salt de potențial la limita de fază datorită formării unui strat electric dublu 5, 6. Dacă o placă de metal, de exemplu, o placă de cupru, este scufundată în apă sau într-o soluție de sare de cupru, atunci ionii Cu2+ încărcați pozitiv vor începe să se miște din stratul metalic situat la granița cu apă în apă. În acest caz, în rețeaua cristalină a metalului apare un exces de electroni, iar placa capătă o sarcină negativă. Între placa încărcată negativ și ionii pozitivi care au trecut în soluție apare o atracție electrostatică, ceea ce împiedică trecerea ulterioară a ionilor de cupru în soluție, adică procesul de dizolvare a metalului se oprește. În același timp, se dezvoltă procesul opus: ionii de cupru din soluție, apropiindu-se de suprafața plăcii, acceptă electroni din aceasta și trec într-o stare neutră. După o anumită perioadă de timp, se stabilește o stare de echilibru dinamic, în care viteza de tranziție a ionilor din metal în soluție este egală cu viteza de descărcare a ionilor din soluție pe metal. Fenomenul descris este prezentat schematic în Fig. 7 (ionii metalici sunt prezentați nehidratați pentru simplitate). Echilibrul dintre ionii din soluție și metal pentru exemplul luat în considerare este exprimat prin ecuația: Cu2+р−р + 2ē Cuºcristal În ecuația de echilibru a unei reacții electrochimice, electronii sunt de obicei scriși pe partea stângă, adică procesul de reducere este notat. Fig.7. Schema apariției unui dublu strat electric la interfața metal-soluție După cum se poate observa din exemplul de mai sus, atunci când un metal intră în contact cu o soluție de sare, cele două faze de contact capătă sarcini opuse. Ca urmare, se formează un strat electric dublu la interfața de fază și are loc un salt de potențial () între metal și soluție. Dacă două plăci metalice din metale diferite (M1 și M11) sunt coborâte în soluție, va apărea un cuplu galvanic în care metalul mai puțin activ va fi redus, iar cel mai activ va fi oxidat (Fig. 8). Orez. 8. Schema de funcționare a unei celule galvanice În general, munca acestei perechi galvanice este determinată de diferența de potențial (emf a celulei galvanice) și este însoțită de bilanțul semireacțiilor: E = ox − red, unde ox este potențialul oxidantului, V; roșu – potențial agent reducător, V. Men+(ox) + ne ⇆ Меº Meº(roșu) − ne ⇄ Меn+. Când numărul de cationi care trec în soluție pe unitatea de timp devine egal cu numărul de cationi depuși pe suprafața metalului, se va produce echilibrul dinamic și procesul de dizolvare se va opri. Prin urmare, trecerea unui număr mare de atomi de ioni metalici în soluție în astfel de condiții este imposibilă. Cu toate acestea, dacă echilibrul stratului dublu electric este perturbat prin descărcarea electronilor sau îndepărtarea atomilor de ioni metalici, procesul de coroziune se va desfășura nestingherit. Potențialele electrodului metalelor care sunt în echilibru cu propriii lor ioni se numesc echilibru. Valoarea potențialului de echilibru poate fi calculată pentru orice activitate ionică folosind ecuația Nernst: E = Eº + (RT /nF)ln(aMen+), (12) n+ unde Eº este diferența de potențial standard la aMe = 1; R – constanta universală a gazului, 8,3 kJ/kmolK; T – temperatura absolută, ºK; n – valența metalului; F – Numărul Faraday 96500 C/mol; 43 aМen+ – activitatea ionilor metalici în mol/l. Dacă înlocuim toate constantele la 25°C (T = 298 K) și înmulțim cu 2,3 pentru a trece de la logaritmii naturali la cei zecimali, obținem următoarea expresie E = Eº + (0,0592/n)log(aMen+), ( 13) Când soluția este diluată, potențialul metalului se deplasează în partea negativă. Dacă, de exemplu, activitatea ionilor de Zn2+ într-o soluție de sare de zinc este de 10–2 mol/l, atunci potențialul de echilibru al zincului scufundat în această soluție va fi egal cu: E = − 0,76 + (0,0592/2) lg10−2 = − 0,819 V, (14) Odată cu creșterea concentrației ionilor metalici în soluție, potențialul metalic, dimpotrivă, se deplasează în direcția pozitivă. Astfel, dacă activitatea ionilor de zinc este luată ca 10 mol/l, atunci potențialul zincului va fi E = − 0,76 + (0,0592/2)log10 = − 0,73 V, (15) Potențialele de electrozi ale metalelor în care The procesul de schimb care determină potențialul implică nu numai propriul său, ci și alți ioni și atomi, care sunt numiți neechilibru sau ireversibili. Pentru potențialele de neechilibru, formula Nernst nu este aplicabilă, deoarece reacțiile care au loc pe metal, i.e. pierderea și achiziția de electroni au loc în moduri diferite, iar potențialul nu poate caracteriza debutul echilibrului oricărei reacții la electrod. Mărimea potențialelor de neechilibru este influențată de natura electrolitului, temperatură, mișcarea electrolitului, concentrația soluției etc. De exemplu, potențialul aluminiului în 3% NaCl este - 0,6 V, în 0,05 M Na2SO4 - 0,47 V, iar în 0,05 M Na2SO4 + H2S − 0,23 V. Datorită eterogenității electrochimice a suprafeței metalului sau electrolitului, pe metal se formează zone cu potențiale diferite. Principalele motive care cauzează eterogenitatea electrochimică a unei suprafețe metalice pot fi următoarele: − LIQUARE − (La liquation, Saigerung) - este capacitatea aliajelor de a se dezintegra în timpul trecerii de la starea lichidă la starea solidă în componente sau compuși individuali care au puncte de topire diferite. ; − eterogenitatea peliculei protectoare; 44 – eterogenitatea condițiilor fizice – temperatură inegală în diferite zone ale metalului, prezența zonelor deformate, concentratoare de tensiuni; − eterogenitatea electroliților - diferență de concentrație de oxigen sau concentrație de sare, valoare diferită a pH-ului. Zonele cu potenţial mai negativ se numesc ANODIC, zonele cu potenţial mai pozitiv se numesc CATOD. Gradul de eterogenitate al suprafeței metalice este determinat de diferența de potențiale a secțiunilor catodice și anodice. 3.2. Termodinamica coroziunii electrochimice Posibilitatea aparitiei spontane a procesului de coroziune este determinata de scaderea energiei libere (potential izobar-izotermic) G< 0: G = −nFE < 0, (16) где n – эквивалентное число электронов; Е = К – А – эдс гальванического элемента, образующегося при контакте металла с окислителем в процессе коррозии; К – обратимый потенциал катодной реакции (окислителя); А – обратимый потенциал анодной реакции (металла – восстановителя); F – число Фарадея. Принципиальная возможность протекания процесса электрохимической коррозии металла имеет место при К > A sau E > 0. Potenţialul redox reversibil al agentului oxidant din electrolit trebuie să fie mai pozitiv în aceste condiţii decât potenţialul reversibil al metalului în aceleaşi condiţii. Pentru a stabili limitele posibilității termodinamice de coroziune electrochimică a metalelor se pot folosi diagramele Pourbaix. Diagramele sunt reprezentări grafice ale dependenței potențialelor reversibile ale electrodului (în volți pe scara hidrogenului) de pH-ul soluției pentru stări de echilibru: cu participarea electronilor - linii orizontale; cu participarea electronilor și ionilor H+ sau OH– - linii înclinate; cu participarea ionilor H+ și OH–, dar fără participarea electronilor (valoarea pH-ului formării hidratului) – linii verticale. 45 Fig.9. Diagrama E – pH pentru sistemul Al-H2O la 25°C Ca exemplu în Fig. Figura 9 prezintă diagrama Pourbaix pentru sistemul Al – H2O. Fiecare regiune a diagramei corespunde unei stări stabile termodinamic: starea metalică, sub formă de ioni în soluție, sub formă de oxizi sau hidroxizi. Întrucât stabilirea echilibrului într-o soluție depinde nu numai de ionii de hidrogen, ci și de alți ioni, delimitarea regiunilor este formată din mai multe linii de echilibru. Fiecare dintre aceste linii corespunde unei activități specifice a ionilor corespunzători. În regiunea din partea de jos a diagramei, metalul aluminiu este stabil termodinamic și nu se corodează. În partea stângă deasupra liniei orizontale, starea aluminiului sub formă de ioni de Al3+ în soluție este stabilă termodinamic. Regiunea de mijloc corespunde stabilității fazelor solide de oxid de Al2O3 sau hidroxid de Al(OH)3, care formează o peliculă protectoare pe suprafața aluminiului în timpul procesului de coroziune. Partea dreaptă caracterizează condițiile în care aluminiul va suferi coroziune cu formarea anionului AlO2– în soluție. 3.3. Mecanismul coroziunii electrochimice Coroziunea metalelor în electroliți are loc odată cu formarea perechilor galvanice, care se numesc perechi de coroziune. Dacă coborâți plăcile de zinc și, respectiv, de fier într-un vas cu soluții de zinc și cloruri de fier (similar cu diagrama pH me din Fig. 8) și le conectați cu un conductor extern, atunci un miliampermetru conectat la circuit va arăta prezența curentului electric în circuit. Se formează un cuplu galvanic în care zincul se va oxida și va intra în soluție (anod). Fierul nu se va oxida și nu va intra în soluție, deoarece, fiind combinat cu zinc, acționează ca un catod. Fierul, care nu este combinat cu zinc, se corodează într-o soluție similară. În practică, aliajele conțin un număr mare de microelemente și metale diferite. Cu alte cuvinte, metalele diferite sunt situate în același plan în contactul lor direct între ele și cu electrolitul. Rezultatul este o celulă multielectrodă în care anozii alternează cu catozii. La locurile anodice, ionii metalici (Men+) intră în soluție. Electronii eliberați (nē) se deplasează prin metal de la anod la catod. Dizolvarea ionilor metalici în soluții apoase trebuie reprezentată ca rezultat al interacțiunii ionilor - atomi localizați pe suprafața exterioară a metalului cu moleculele polare de apă. Interacțiunea ionilor metalici dizolvați cu dipolii de apă este cauzată de forțele de atracție electrostatică. Ca urmare, în jurul fiecărui ion, într-o măsură mai mare sau mai mică (în funcție de mărimea încărcăturii sale), se formează un înveliș de dipoli de apă (fenomenul de hidratare). Datorită hidratării, raza efectivă a ionului crește, drept urmare mobilitatea ionilor hidratați scade semnificativ. Procesul de hidratare este însoțit de eliberarea de energie, în timp ce procesul de deshidratare necesită energie. Pe lângă dipolii de apă, ionul poate fi acoperit cu o înveliș de alți dipoli. Mai general, acest fenomen se numește solvatare15. Astfel, coroziunea electrochimică constă în următoarele etape, care se desfășoară în paralel: - un proces anodic, care constă în trecerea ionilor metalici de la suprafață în soluție și hidratarea acestora: SOLVARE - procesul de formare a asociaților între un solvent și un dizolvat. substanță, produsul solvației este SOLVATE. Dacă solventul este apă, atunci HIDRATARE, produsul hidratării este HIDRATARE. 15 47 Meº − nē Men+ + mH2O Men+ mH2O. hidratul este un proces catodic, care constă în asimilarea (captarea) electronilor de către un depolarizator (D): D + nē . Deoarece procesele anodice și catodice sunt independente și apar mai ușor: anodicul în zonele cu un potențial inițial mai negativ al suprafeței, iar catodic în cele mai pozitive - iar în condiții practice eterogenitatea electrochimică a suprafeței metalice necesară pentru aceasta este notat, aceste procese au loc predominant într-o manieră localizată. Fluxul curentului electric se realizează pe metal - prin mișcarea electronilor din zonele anodice către catod, iar în soluție, în același timp, are loc mișcarea ionilor. Astfel, puterea curentului poate servi și servește drept criteriu pentru viteza de coroziune electrochimică. Calculați consumul de material al anodului, de ex. cantitatea de metal corodat de la 1 cm2 din suprafața sa poate fi utilizată folosind formula lui Faraday: K = Q A / F n = i A / F n, unde K este cantitatea de metal corodat. metal, g/cm2; Q este cantitatea de electricitate care curge în timpul τ, [s] între secțiunile anodului și catodului; i – densitatea curentului, A/cm2; F – numărul Faraday; n – valența metalului; A este masa atomică a metalului. 3.4. Polarizarea proceselor electrodului și cauzele sale Când electrozii unui element de coroziune sunt scurtcircuitați, are loc o modificare semnificativă a potențialelor electrodului, dar rezistența perechii practic nu se modifică. În acest caz, se observă o scădere a forței electromotoare a elementului de coroziune. O modificare a potențialelor inițiale, care duce la o scădere a curentului de coroziune și, în consecință, a vitezei de coroziune, se numește POLARIZARE. Modificarea potențialelor (16) ale electrozilor în timpul funcționării elementului de coroziune arată că potențialul catodic devine mai negativ (POLARIZARE CATODĂ), iar potențialul anodic devine mai pozitiv (POLARIZARE ANODICĂ): K = Ko – K, (17) o A = A + A, (18) unde K și A sunt valorile potențiale ale electrozilor elementului de lucru; Кº și Аo – valorile inițiale ale potențialelor electrodului înainte de închiderea circuitului; K și A – deplasarea potențialului (polarizarea) catodului și anodului. Astfel, diferența de potențial E = K − A scade. POLARIZAREA este o consecință a întârzierii proceselor electrodului din fluxul de electroni într-un element scurtcircuitat. Rezistențele ohmice (R) au un efect redus asupra reducerii curentului de coroziune, deoarece sunt de obicei mici. De mare importanță sunt rezistențele de polarizare, care sunt asociate fie cu dificultăți în descărcarea electronilor la catod (Pk), fie cu dificultăți în tranziția ionilor metalici pozitivi din rețeaua metalică în soluție (PA). Aceste rezistențe, care au o dimensiune ohmică, sunt principalul motiv pentru scăderea vitezei de coroziune electrochimică. Puterea curentului în momentul închiderii circuitului în conformitate cu legea lui Ohm este determinată de formula Iinit = (Кº − Аo)/R, (19). Valoarea inițială a curentului de coroziune (Iinit) este direct proporțională cu diferența dintre potențialul inițial Kº și Ao, cu condiția ca Kº > Ao și invers proporțională cu rezistența. Curentul de coroziune în regim permanent (Icelula de lucru) este determinat de ecuația: Icelula de lucru = (K – A)/(R + PA + PK). Astfel, lucrez. el−ta< Iнач. Снижению скорости электрохимической коррозии или уменьшению коррозионного тока могут способствовать: − уменьшение степени термодинамической стабильности, т. е. сближение равновесных потенциалов анодного Аº и катодного Кº процессов; − торможение катодных процессов, иначе говоря, увеличение катодной поляризуемости РК; 49 − торможение анодных процессов, то есть увеличение анодной поляризуемости РА. Поляризация является весьма желательным явлением в коррозионных процессах, так как электроды замкнуты накоротко, омическое сопротивление их невелико и, следовательно, не будь поляризационных сопротивлений, коррозия протекла бы весьма интенсивно. Всякое воздействие, уменьшающее поляризацию, увеличивает скорость коррозионных процессов. Факторы, уменьшающие поляризацию электродов коррозионного элемента, называют ДЕПОЛЯРИЗАТОРАМИ, а процессы, протекающие при этом – АНОДНОЙ И КАТОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ. 3.4.1. Анодная поляризация Анодная поляризация обычно оказывает меньшее влияние на изменение разности потенциалов элемента по сравнению с катодной поляризацией. Анодный процесс, заключающийся в ионизации металла и гидратировании ионов по уравнению: Men+ + mH2O → Men+ ∙ mH2O, может протекать беспрепятственно только при условии беспрерывного отвода образующихся ионов из прианодной зоны. Торможение анодного процесса будет иметь место и в случае отставания скорости выхода ионов металла в раствор от скорости перетекания электронов на катодные участки. В результате анодной поляризации отрицательный заряд на металлической обкладке двойного слоя уменьшается, а следовательно, потенциал металла сдвинется в положительную сторону (или станет менее отрицательны). Таким образом, анодная поляризация происходит или в связи с тем, что скорость анодного процесса не поспевает за скоростью отвода электронов (перенапряжение ионизации металла), или потому, что из−за недостаточно быстрого отвода перешедших в раствор ионов металла повышается концентрация этих ионов в прианодной зоне (концентрационная поляризация). Чем легче протекает анодный процесс, тем меньше его поляризуемость. Следить за тем, легко ли протекает анодный процесс или он заметно тормозится, можно по ходу поляризационной анодной кри50 Потенциал, В вой. Эта кривая показывает зависимость потенциала электрода от плотности анодного тока на нем. Такая кривая показана на рис. 10. Удаление продуктов анодной реакции вызывает деполяризацию анода. Деполяризация анода может быть ускорена перемешиЕ Е ванием раствора, образованием о А таких продуктов коррозии, которые выпадают в осадок, а также путем образования комплексных соединений. Вследствие связывания в комплекс ионов металла, перешедших в раствор, концентрация их в прианодной зоне уменьшаПлотность тока, мА/см2 ется; анодная поляризация сниРис. 10. Анодная поляризаци- жается и переход ионов в расонная кривая твор, т.е. коррозия, усиливается. Например, медь и ее сплавы образуют в растворе аммиака хорошо растворимый комплексный ион 2+. Этим объясняется сильная коррозия меди и ее сплавов в аммиачных растворах. Поляризация анодного процесса в обычных условиях происходит в незначительной степени. Исключение представляет случай возникновения анодной пассивности. 3.4.2. Катодная поляризация Протекание катодной реакции могут тормозить два основных процесса: − торможение за счет трудности протекания самой реакции присоединения электрона деполяризатором, т. е. задержка в реакции nē + D (Dnē). Затруднение протекания катодного процесса по этой причине называется ПЕРЕНАПРЯЖЕНИЕМ РЕАКЦИИ КАТОДНОЙ ДЕПОЛЯРИЗАЦИИ; − торможение в процессе подвода к катодной поверхности деполяризатора (D) или отвода от катодной поверхности продуктов восстановления деполяризатора (Dnē). Затруднение катодного процесса по этой причине называется КОНЦЕНТРАЦИОННОЙ ПОЛЯРИЗАЦИЕЙ КАТОДА. 51 Всякий процесс захвата электрона на катоде, т.е. всякий процесс восстановления какого−либо вещества может являться катодной деполяризующей реакцией. Деполяризация катода может протекать различными путями: − ассимиляция электронов ионами: 2H+ +2ē H2, Fe3+ + ē Fe2+, Cu2+ + ē Cu+, S2O8– + ē 2SO42–; − ассимиляция электронов нейтральными молекулами: О2 + 4ē + 2Н2О 4ОН–, Cl2 + 2ē 2Cl–, Н2О2 + 2ē 2ОН–; − ассимиляция электронов нерастворимыми пленками Fe3O4 + 2ē + H2O 3FeO + 2OH–, Fe(OH)3 + ē Fe(OH)2 + OH–; − ассимиляция электронов органическими соединениями RO + 2ē + 4H+ RH2 + H2O, R + 2ē + 2H+ RH2, где R – радикал или органическая молекула. Наиболее часто встречаемыми и наиболее важными катодными деполяризационными процессами являются два: а) разряд и выделение водорода (деполяризатор ион водорода) 2H+ +2ē H2. В этом случае коррозионный процесс называется коррозией с ВОДОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ. Этому виду коррозии подвержены электроотрицательные металлы в кислотах и весьма электроотрицательные металлы, например Mg, в воде и нейтральных растворах электролитов; б) восстановление атомов или молекул кислорода электронами, притекающими на катодных участках − КИСЛОРОДНАЯ ДЕПОЛЯРИЗАЦИЯ: О2 + Н2О + 4ē 4ОН–. Деполяризатором здесь является растворенный в электролите кислород. Этот вид коррозии является наиболее распространенным. Так корродирует большинство металлов в атмосфере, почве, нейтральных растворах электролитов. Иногда оба деполяризующие процесса протекают параллельно, как например, при коррозии железа в разбавленных растворах серной кислоты в присутствии кислорода воздуха. 52 3.4.3. Водородная деполяризация Протекание коррозии металла с водородной деполяризацией возможно, если (Me)обр < (н2)обр. (20) Согласно уравнению Нернста (н2)обр = (н2)ºобр + (RT2,3/F)lg(aH+/pH21/2), (21) о где (н2) обр – стандартный обратимый потенциал водородного электрода при всех температурах (при ан+ = 1 и рН2 = 1 ат); R – универсальная газовая постоянная. Ниже приведены значения обратимого потенциала водородного электрода (н2)обр при 25 оС и различных значениях рН среды и pН2. рн2, ат 5∙10 1 –7 0 + 0,186 0 рН среды 7 − 0,228 − 0,414 14 − 0,641 − 0,828 Изменение потенциала катода при катодной деполяризации выделением водорода подчиняется ближе всего логарифмической зависимости от плотности тока. Эта зависимость определяется выражением: К = Кº – (а + b lg i). (22) Для очень малых плотностей катодного тока (меньше 10–4 – 10–5 А/см2) потенциал от плотности тока имеет линейную зависимость. Поэтому при i = 0 К = Кº, а не бесконечности, как это следует из уравнения. Поляризуемость катода при выделении на нем водорода принято определять ВЕЛИЧИНОЙ ПЕРЕНАПРЯЖЕНИЯ ВОДОРОДА на данном материале катода. Под ПЕРЕНАПРЯЖЕНИЕМ ВОДОРОДА понимают сдвиг потенциала катода при данной плотности тока в отрицательную сторону по сравнению с потенциалом водорода в том же растворе (без наложения тока) и обозначают через η η = − (К − Кº) (23) или η = a + blgI, (24) где b – константа, не зависящая от материала, рассчитывается как 2,3 ∙ 2RT / nF; а − константа, зависит от природы и состояния поверхности материала катода и численно равна величине перенапряжения при плотности тока, равной единице. 53 Поляризационная кривая для случая водородной деполяризации имеет вид кривой Кº MN (рис. 11). − N 1 M η Рис. 11. Катодная поляризационная кривая для процесса водородной деполяризации ко или (н2)обр i1 0 i P Если по оси абсцисс взять не плотность тока, а логарифм этой величины, то кривая перенапряжения будет прямой. В этом случае константа b является тангенсом угла наклона полученной прямой к оси абсцисс, константа а равна величине ординаты lg i = 0 (т.е. при плотности тока i = 1). Величина перенапряжения водорода зависит от плотности тока, т.е. при данной силе тока, от истинных размеров поверхности катода. При одинаковой силе тока она больше на гладкой поверхности, чем на шероховатой. 3.4.4. Кислородная деполяризация Процессы коррозии с КИСЛОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ могут протекать в том случае, если при данных условиях обратимый потенциал металла отрицательнее обратимого потенциала кислородного электрода (Me)обр < (О2)обр. (25) 54 Обратимый потенциал кислородного электрода может быть вычислен по уравнению Нернста: (О2)обр = (О2)ºобр + (RT2,3/4F)lg(pО2/a4ОH−) (26) где (О2)ºобр – стандартный обратимый потенциал кислородного электрода (при аOH– = 1 и рО2 = 1 ат); рО2 – парциальное давление кислорода; аОН– – активность гидроксильных ионов. Величина обратимого потенциала кислородного электрода (О2)ºобр при 25 oC для различных значений рН и рО2: рН среды ро2 , ат 0,21 1 0 + 1,218 + 1,229 7 + 0,805 + 0,815 14 + 0,391 + 0,400 Коррозия с кислородной деполяризацией является термодинамически более возможным процессом, чем коррозия с водородной деполяризацией, так как равновесный потенциал восстановления кислорода более положителен, чем равновесный потенциал выделения водорода. Коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом. Коррозии с кислородной деполяризацией подвергаются металлическая обшивка нефтезаводской аппаратуры и оборудования, детали аппаратов, соприкасающиеся с водой и нейтральными водными растворами солей (например, трубы конденсационно−холодильного оборудования), подземные трубопроводы, днища резервуаров и др. При коррозии металлов с кислородной деполяризацией катодный процесс определяется перенапряжением катодной реакции и скоростью подвода кислорода к электроду. Замедленность катодной реакции по схеме: О2 + 2Н2О + 4е 4ОН– (в щелочных или нейтральных растворах), или по схеме: О2 + 4Н+ + 4е 2Н2О (в слабо−кислых растворах) называется ПЕРЕНАПРЯЖЕНИЕМ ИОНИЗАЦИИ КИСЛОРОДА. При больших плотностях тока (при iк > 10–2 A/m2) și o rată semnificativă de alimentare cu oxigen a catodului, supratensiunea de ionizare a oxigenului are o dependență logaritmică de densitatea de curent 55 δ" = а"+ b" log i, (27) unde δ" este supratensiunea de ionizare a oxigenului; a" este o constantă care depinde de materialul catodic și de starea suprafeței acestuia, de temperatură și de alți factori. Este definită numeric ca valoarea supratensiunii la i = 1; b" este o constantă care nu depinde de materialul catodic; se determină din egalitatea b" = 2RT/nF ∙ 2,3; la o temperatură de 20° și n = 1, b" = 0,117. Mecanismul reducerii catodice a oxigenului este destul de complex și are loc în mai multe etape: dizolvarea oxigenului în electrolit, transferul oxigenului dizolvat în secțiunile catodice ale metalului, ionizarea oxigenului. Spre deosebire de depolarizarea hidrogenului, pentru care polarizarea concentrației este practic nesemnificativă, în coroziunea metalelor cu depolarizarea oxigenului joacă un rol foarte important datorită ratei limitate de alimentare cu oxigen a catodului. Acest lucru se explică prin solubilitatea scăzută a oxigenului în soluția de electrolit și, în consecință, concentrația sa scăzută, dificultatea difuzării oxigenului printr-un strat staționar de lichid adiacent catodului. Cu agitare puternică a soluției, circulație intensă sau în condiții care asigură o aerare semnificativă a electrolitului, procesul de coroziune este inhibat de o supratensiune a ionizării oxigenului. Procesele de difuzie afectează viteza de coroziune atunci când metalul este scufundat într-o soluție calmă sau ușor agitată. Curba generală de polarizare catodică are o formă complexă (Fig. 12) și reprezintă totalul a trei curbe care caracterizează polarizarea în timpul ionizării oxigenului (AB), polarizarea concentrației (DE) și descărcarea ionilor de hidrogen (GFH). În prima secțiune, viteza procesului catodic, i.e. cantitatea de oxigen redusă pe unitatea de timp este mai mică decât rata maximă posibilă de livrare a oxigenului la suprafață prin difuzie. În acest sens, în această zonă viteza procesului este limitată în principal de încetineala procesului de reducere a oxigenului în sine. 56 − H F K E G (H2)arr 0 (O2)arr A D B C iд i Fig. 12 Curba de polarizare a catodului pentru procesul de depolarizare a oxigenului Odată cu o creștere suplimentară a densității de curent, potențialul se deplasează în direcția negativă, mai întâi treptat, si apoi brusc (sectiunea CDE). O schimbare bruscă a potențialului în direcția negativă este asociată cu polarizarea concentrației din cauza scăderii concentrației de oxigen. La o anumită valoare potențială, devine posibil un nou proces catodic, de obicei asociat cu depolarizarea hidrogenului (secțiunea EK). 3.5. Controlul factorului de coroziune Procesul de coroziune electrochimică a metalelor și aliajelor constă din procese sau etape elementare. Viteza reală a procesului de coroziune depinde direct de inhibarea sa totală în fiecare etapă. Procentul de inhibiție a procesului global în fiecare dintre etapele sale caracterizează GRADUL DE CONTROL AL PROCESULUI la o etapă dată. 57 se numește etapa care determină viteza de coroziune, deoarece are cea mai mare rezistență în comparație cu alte etape. PROCESUL DE CONTROL o2)arr imax I imax b b b a (o2)arr in A A imax (Me)arr (Me)arr K ∆K R o2) I I S (о2)arr i I g g d d Fig. 13. Diagrame de coroziune de polarizare pentru principalele cazuri practice de monitorizare a proceselor de coroziune electrochimică 58 I în În condiții practice, există mai multe cazuri de bază de monitorizare a coroziunii electrochimice a metalelor și aliajelor, fundamentate prin N.D. Tomașov. Bekkerev I.V. „Metale și aliaje - Calități, compoziție chimică”, Partea 2, Ulyanovsk: Universitatea Tehnică de Stat din Ulyanovsk, 2007. - p. 630, http://www.bibliotekar.ru/spravochnik-73/index.htm. 3]. Semenova I.V. Coroziune și protecție împotriva coroziunii, M.: Fizmatlit, 2002, 335 p. 4]. Khaldeev G.V., Borisova T.F. „Permeabilitatea la hidrogen a metalelor și aliajelor în procesele electrochimice de coroziune. Electrochimie” – Volumul 30, Moscova, 1989 p. 232 5]. T. L. Lukanina, T. T. Ovchinnikova, V. Ya Sigaev, „Chimie generală” Partea a II-a. Tutorial. Ediția a II-a, corectată și extinsă, 2006)