கட்டுமானப் பொருட்களின் இரசாயன எதிர்ப்பு அவற்றின் கலவை மற்றும் கட்டமைப்பைப் பொறுத்து. பொருட்களின் தொழில்நுட்ப பண்புகள். பொருட்களின் இரசாயன எதிர்ப்பு Vladislav Aleksandrovich Likhachev x வேலையின் முக்கிய படிப்பு
பொது மற்றும் தொழிற்கல்வி அமைச்சகம்
இரஷ்ய கூட்டமைப்பு
மாஸ்கோ மாநில சுற்றுச்சூழல் பொறியியல் பல்கலைக்கழகம்
A.G.Parshin V.S.Pakhomov D.L.Lebedev
பொருட்களின் இரசாயன எதிர்ப்பு மற்றும் அரிப்பு பாதுகாப்பு
ஆய்வக பட்டறை
டாக்டர். டெக் மூலம் திருத்தப்பட்டது. அறிவியல் ஏ.ஏ
மாஸ்கோ-1998
BBK35.11 Χ 46
விமர்சகர்கள்:
அரிப்பைத் துறை, மாஸ்கோ மாநில எண்ணெய் மற்றும் எரிவாயு அகாடமி பெயரிடப்பட்டது. குப்கின்;
பிஎச்.டி. தொழில்நுட்பம். அறிவியல் A.S அப்ரமோவ், சுற்றுச்சூழல் நிறுவனம் "ShanEco", மாஸ்கோ.
மாஸ்கோ மாநில சுற்றுச்சூழல் பொறியியல் பல்கலைக்கழகத்தின் ஆசிரியர் மற்றும் வெளியீட்டு கவுன்சில் மூலம் கற்பித்தல் உதவியாக அங்கீகரிக்கப்பட்டது.
பார்ஷின் ஏ.ஜி., பகோமோவ் வி.எஸ்., லெபடேவ் டி.எல்.
Χ 46 பொருட்களின் இரசாயன எதிர்ப்பு மற்றும் அரிப்பு பாதுகாப்பு: ஆய்வக பட்டறை / எட். A.A. Shevchenko - M.: MGUIE, 1998.-80 pp.; நோய்.8.
ISBN 5-230-11142-9
பட்டறையில் மின் வேதியியல் அரிப்பு மற்றும் உலோகங்களின் பாதுகாப்பு குறித்த நான்கு ஆய்வகப் பணிகள் உள்ளன: “ஹைட்ரஜன் அயனிகளைக் குறைக்கும் போது உலோகங்களின் அரிப்பு மீது கட்டமைப்பு பன்முகத்தன்மையின் தாக்கம்”, “ஆக்சிஜன் டிபோலரைசேஷன் கொண்ட உலோகங்களின் அரிப்பு”, “எலக்ட்ரோட் சாத்தியங்கள்”, “தொடர்பு அரிப்பு. மற்றும் அரிப்பிலிருந்து உலோகங்களின் கத்தோடிக் பாதுகாப்பு”. உலோகங்களின் மின் வேதியியல் அரிப்பு கோட்பாட்டின் அடிப்படைக் கருத்துக்கள் மற்றும் அரிப்பு ஆராய்ச்சியை நடத்துவதற்கான முறை ஆகியவை கோடிட்டுக் காட்டப்பட்டுள்ளன. 3 மற்றும் 4 ஆம் ஆண்டு முழுநேர மாணவர்களுக்காக வடிவமைக்கப்பட்டது, பொருட்களின் இரசாயன எதிர்ப்பு மற்றும் அரிப்பு பாதுகாப்பு பற்றிய படிப்பைப் படிக்கிறது.
ISBN 5-230-11142-9 UDC620.193 BBK 35.11
© A.G.Parshin, V.S.Pakhomov, D.L.Lebedev.1998
© MSUIE, 1998
முன்னுரை
ஆய்வக பட்டறை "பொருட்களின் இரசாயன எதிர்ப்பு மற்றும் அரிப்பு பாதுகாப்பு" என்ற பாடத்திட்டத்தின் படி எழுதப்பட்டுள்ளது, இது பல சிறப்புகளின் பாடத்திட்டத்தில் வழங்கப்படுகிறது. பட்டறையில் உலோகங்களின் மின்வேதியியல் அரிப்பைப் பற்றிய வேலைகள் அடங்கும், இது கலப்பு பொருட்கள் மற்றும் அரிப்பு பாதுகாப்பு துறையில் உருவாக்கப்பட்டது.
ஒவ்வொரு ஆய்வக வேலையும் ஒரு தத்துவார்த்த பகுதியுடன் தொடங்குகிறது. ஹைட்ரஜன் அயனிகளின் கத்தோடிக் குறைப்பின் போது ஏற்படும் அரிப்பின் இயக்கவியல், வெப்ப இயக்கவியல் மற்றும் இயக்கவியல், உலோக-எலக்ட்ரோலைட் இடைமுகத்தில் ஆக்ஸிஜன் டிபோலரைசேஷன், சமநிலை மற்றும் சமநிலையற்ற செயல்முறைகள் மற்றும் எலக்ட்ரோடு சாத்தியக்கூறுகளின் கோட்பாடு ஆகியவை கருதப்படுகின்றன.
கோட்பாட்டு சிக்கல்களை முன்வைக்கும்போது, அரிப்பு செயல்முறைகளின் இயக்கவியல் மற்றும் இயக்கவியல் பற்றிய நவீன மின்வேதியியல் கருத்துக்கள் பயன்படுத்தப்படுகின்றன.
ஆய்வகப் பணிகளைச் செய்வது, அரிப்பு மற்றும் உலோகங்களைப் பாதுகாப்பது பற்றிய ஆய்வின் அடிப்படைகளை மாணவர்கள் நன்கு புரிந்துகொள்ள அனுமதிக்கிறது, மேலும் அடிப்படை ஆய்வக அரிப்பு-மின்வேதியியல் ஆராய்ச்சியை நடத்துவதில் திறன்களை வளர்க்கிறது.
ஆய்வக நாட்குறிப்பை வைத்திருத்தல்
1) வேலையின் தலைப்பு மற்றும் நோக்கம்;
2) நிறுவல் வரைபடம்;
3) சோதனைகளின் முடிவுகள் மற்றும் அவற்றின் செயலாக்கம் (கணக்கீடுகள், வரைபடங்கள்) கொண்ட அட்டவணை;
4) முடிவுகள்.
பத்திரிகை சுத்தமாகவும் உடனடியாகவும் சுத்தமாக இருக்க வேண்டும், அதாவது. அனைத்து ஆராய்ச்சி மற்றும் சோதனை நடவடிக்கைகளின் பதிவுகள் அதே வழியில் வைக்கப்படுகின்றன.
நிறுவல் வரைபடம் வாய்மொழி விளக்கங்கள் இல்லாமல் தெளிவாகவும் புரிந்துகொள்ளக்கூடியதாகவும் இருக்க வேண்டும்.
சோதனை நிலைமைகளை வழங்குவது அவசியம்: சோதனை செய்யப்பட்ட பொருட்கள், மாதிரிகளின் மேற்பரப்பு, கலவை மற்றும் எலக்ட்ரோலைட்டுகளின் செறிவு, வெப்பநிலை போன்றவை.
சோதனை முடிவுகள் முன் தொகுக்கப்பட்ட அட்டவணையில் பதிவு செய்யப்பட வேண்டும், அவற்றின் வடிவங்கள் வேலையின் விளக்கத்தில் கொடுக்கப்பட்டுள்ளன.
பல்வேறு அளவுகளை பதிவு செய்யும் போது, அவற்றின் பரிமாணத்தைக் குறிப்பிடுவது அவசியம். அளவீட்டு முடிவுகள், ஒரு விதியாக, கூடுதல் செயலாக்கத்திற்கு உட்பட்டவை - பகுப்பாய்வு மற்றும் வரைகலை (வெகுஜன கணக்கீடு, தொகுதி மற்றும் அரிப்பை ஆழமான குறிகாட்டிகள், சாத்தியங்கள் போன்றவை). இந்த சந்தர்ப்பங்களில், கணக்கீடு சூத்திரம் மற்றும் ஒரு கணக்கீட்டை முழுமையாக வழங்குவது அவசியம், அதாவது. சோதனை மதிப்புகளை சூத்திரத்தில் மாற்றுவது மற்றும் பிற ஒத்த கணக்கீடுகளுக்கு - இறுதி முடிவுகள் மட்டுமே.
பெறப்பட்ட மற்றும் அதற்கேற்ப செயலாக்கப்பட்ட முடிவுகளின் அடிப்படையில், செய்யப்பட்ட வேலை பற்றிய சுருக்கமான முடிவுகள் எடுக்கப்பட வேண்டும். முடிந்ததும், விசாவிற்காக ஆசிரியரிடம் சோதனைத் தரவுகளுடன் இதழைச் சமர்ப்பிக்கவும்.
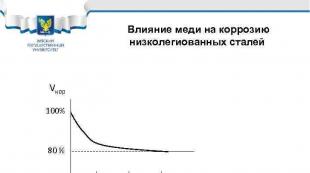
 குறைந்த அலாய் ஸ்டீல்களின் அரிப்பில் தாமிரத்தின் செல்வாக்கு Vcor 100% 80% 0. 1 0. 2 0. 3% Cu எஃகுகளின் எடுத்துக்காட்டுகள்: 10 HSND, 10 G 2 S 1 D, 10 KhDNP, 09 G 2 D, 18 G 2 AF(D)
குறைந்த அலாய் ஸ்டீல்களின் அரிப்பில் தாமிரத்தின் செல்வாக்கு Vcor 100% 80% 0. 1 0. 2 0. 3% Cu எஃகுகளின் எடுத்துக்காட்டுகள்: 10 HSND, 10 G 2 S 1 D, 10 KhDNP, 09 G 2 D, 18 G 2 AF(D)
 அரிப்பை எதிர்க்கும் இரும்புகளின் வகைப்பாடு 1. அரிப்பை எதிர்க்கும் (துருப்பிடிக்காத) இரும்புகள் மற்றும் உலோகக்கலவைகள் எலக்ட்ரோலைட்டுகளில் மின்வேதியியல் அரிப்பை எதிர்க்கும் பொருட்கள். 2. அரிப்பை எதிர்க்கும் கலவையின் முக்கிய கலவை உறுப்பு குரோமியம் ஆகும். 3. குரோமியம் தம்மன் விதியின்படி துருப்பிடிக்காத இரும்புகளில் அறிமுகப்படுத்தப்பட்டது. 4. இந்த இரும்புகள் பயன்படுத்தப்படும் சூழல்களைப் பொறுத்து, அரிப்பை எதிர்க்கும் (துருப்பிடிக்காத) இரும்புகள் மற்றும் உலோகக் கலவைகளின் ஐந்து குழுக்கள் வேறுபடுகின்றன.
அரிப்பை எதிர்க்கும் இரும்புகளின் வகைப்பாடு 1. அரிப்பை எதிர்க்கும் (துருப்பிடிக்காத) இரும்புகள் மற்றும் உலோகக்கலவைகள் எலக்ட்ரோலைட்டுகளில் மின்வேதியியல் அரிப்பை எதிர்க்கும் பொருட்கள். 2. அரிப்பை எதிர்க்கும் கலவையின் முக்கிய கலவை உறுப்பு குரோமியம் ஆகும். 3. குரோமியம் தம்மன் விதியின்படி துருப்பிடிக்காத இரும்புகளில் அறிமுகப்படுத்தப்பட்டது. 4. இந்த இரும்புகள் பயன்படுத்தப்படும் சூழல்களைப் பொறுத்து, அரிப்பை எதிர்க்கும் (துருப்பிடிக்காத) இரும்புகள் மற்றும் உலோகக் கலவைகளின் ஐந்து குழுக்கள் வேறுபடுகின்றன.
 லேசான ஆக்கிரமிப்பு சூழல்களுக்கு அரிப்பை-எதிர்ப்பு இரும்புகள் முதல் குழுவின் இரும்புகள் ஒரு மூடிய வளிமண்டலத்தில் மற்றும் நீருக்கடியில் அரிப்பை கட்டாயமாக அவ்வப்போது உலர்த்துவதன் மூலம் மட்டுமே வேலை செய்ய முடியும். திறந்த வளிமண்டலம் மற்றும் நிலையான நீருக்கடியில் அரிப்பு (குறிப்பாக சூடான நீரில்), அத்துடன் நிலத்தடி அரிப்பு ஆகியவற்றில், இந்த இரும்புகள் அரிப்புக்கு உட்பட்டவை. இந்த இரும்புகளில் குரோமியம் ஸ்டீல்கள் அடங்கும்: 08 X 13, 09 X 13, 08 X 17 G (ferritic), 10 X 13, 12 X 13 (martensitic-ferritic), 20 X 13, 30 X 13, 40 X 13 (martensitic) . நிக்கல் (2 -4%) 15 X 17 AG 14, 10 X 14 AG 15, 10 X 14 G 14 N 3 T, 12 X 17 G 14 N 3 ஆகியவற்றின் சிக்கனமான கலவையுடன் குரோம்-மாங்கனீசு மற்றும் குரோம்-நிக்கல் இரும்புகள் , 08 X 18 G 8 N 2 T
லேசான ஆக்கிரமிப்பு சூழல்களுக்கு அரிப்பை-எதிர்ப்பு இரும்புகள் முதல் குழுவின் இரும்புகள் ஒரு மூடிய வளிமண்டலத்தில் மற்றும் நீருக்கடியில் அரிப்பை கட்டாயமாக அவ்வப்போது உலர்த்துவதன் மூலம் மட்டுமே வேலை செய்ய முடியும். திறந்த வளிமண்டலம் மற்றும் நிலையான நீருக்கடியில் அரிப்பு (குறிப்பாக சூடான நீரில்), அத்துடன் நிலத்தடி அரிப்பு ஆகியவற்றில், இந்த இரும்புகள் அரிப்புக்கு உட்பட்டவை. இந்த இரும்புகளில் குரோமியம் ஸ்டீல்கள் அடங்கும்: 08 X 13, 09 X 13, 08 X 17 G (ferritic), 10 X 13, 12 X 13 (martensitic-ferritic), 20 X 13, 30 X 13, 40 X 13 (martensitic) . நிக்கல் (2 -4%) 15 X 17 AG 14, 10 X 14 AG 15, 10 X 14 G 14 N 3 T, 12 X 17 G 14 N 3 ஆகியவற்றின் சிக்கனமான கலவையுடன் குரோம்-மாங்கனீசு மற்றும் குரோம்-நிக்கல் இரும்புகள் , 08 X 18 G 8 N 2 T
 உப்புச்சூழலுக்கான அரிப்பை-எதிர்ப்பு (துருப்பிடிக்காத) இரும்புகள் இரண்டாவது குழு அரிப்பை-எதிர்ப்பு (துருப்பிடிக்காத) இரும்புகள் குறைந்த வெப்பநிலையில் உப்பு சூழலில், குறிப்பாக கடல் அரிப்பின் போது பயன்படுத்தப்படுகின்றன. Ni இரும்புகள் (5 - 8%) கூடுதல் சிக்கனமான கலவை மூலம் அதிகரித்த அரிப்பு எதிர்ப்பு அடையப்படுகிறது. எடுத்துக்காட்டுகள்: 09 X 15 N 8 Yu, 07 X 16 N 6, 08 X 17 N 5 M 3 (கந்தக அமில சூழலில் எஃகு பயன்படுத்தப்படுகிறது), 09 X 17 N 7 Yu 1 (எஃகுகள் கடல் அரிப்பு நிலைகளில் பயன்படுத்தப்படுகின்றன).
உப்புச்சூழலுக்கான அரிப்பை-எதிர்ப்பு (துருப்பிடிக்காத) இரும்புகள் இரண்டாவது குழு அரிப்பை-எதிர்ப்பு (துருப்பிடிக்காத) இரும்புகள் குறைந்த வெப்பநிலையில் உப்பு சூழலில், குறிப்பாக கடல் அரிப்பின் போது பயன்படுத்தப்படுகின்றன. Ni இரும்புகள் (5 - 8%) கூடுதல் சிக்கனமான கலவை மூலம் அதிகரித்த அரிப்பு எதிர்ப்பு அடையப்படுகிறது. எடுத்துக்காட்டுகள்: 09 X 15 N 8 Yu, 07 X 16 N 6, 08 X 17 N 5 M 3 (கந்தக அமில சூழலில் எஃகு பயன்படுத்தப்படுகிறது), 09 X 17 N 7 Yu 1 (எஃகுகள் கடல் அரிப்பு நிலைகளில் பயன்படுத்தப்படுகின்றன).
 நடுத்தர அரிக்கும் தன்மை கொண்ட சூழல்களில் பயன்படுத்த இரும்புகள் வெவ்வேறு வெப்பநிலையில் உப்புகளின் தீர்வுகள், அத்துடன் சில அமிலங்களின் பலவீனமான தீர்வுகள். மூன்றாவது குழுவின் இரும்புகள் பரந்த பயன்பாட்டுடன் மிகவும் பொதுவான துருப்பிடிக்காத இரும்புகள் ஆகும். இந்த எஃகுகளில் நாம் வேறுபடுத்தி அறியலாம்: அ) இரும்புகள் - உயர் நிக்கல் இரும்புகளுக்கான மாற்று: 15 X 25 T, 15 X 28, 08 X 22 N 6 T, 12 X 21 N 5 T. b) நிக்கலுக்கு உகந்த குரோமியம் கொண்ட இரும்புகள் விகிதம் (Cr: Ni = 18: 9, 18: 10): 12 X 18 N 9 T மற்றும் 12 X 18 N 10 T, 17 X 18 N 9, 12 X 18 N 10 B, 08 X 18 N 10, 12 X 18 N 12 T, 08 X 18 N 12 B, 06 X 18 N 11, முதலியன
நடுத்தர அரிக்கும் தன்மை கொண்ட சூழல்களில் பயன்படுத்த இரும்புகள் வெவ்வேறு வெப்பநிலையில் உப்புகளின் தீர்வுகள், அத்துடன் சில அமிலங்களின் பலவீனமான தீர்வுகள். மூன்றாவது குழுவின் இரும்புகள் பரந்த பயன்பாட்டுடன் மிகவும் பொதுவான துருப்பிடிக்காத இரும்புகள் ஆகும். இந்த எஃகுகளில் நாம் வேறுபடுத்தி அறியலாம்: அ) இரும்புகள் - உயர் நிக்கல் இரும்புகளுக்கான மாற்று: 15 X 25 T, 15 X 28, 08 X 22 N 6 T, 12 X 21 N 5 T. b) நிக்கலுக்கு உகந்த குரோமியம் கொண்ட இரும்புகள் விகிதம் (Cr: Ni = 18: 9, 18: 10): 12 X 18 N 9 T மற்றும் 12 X 18 N 10 T, 17 X 18 N 9, 12 X 18 N 10 B, 08 X 18 N 10, 12 X 18 N 12 T, 08 X 18 N 12 B, 06 X 18 N 11, முதலியன
 அதிகரித்த அரிக்கும் தன்மை கொண்ட சூழலில் பயன்படுத்த இரும்புகள் இந்த வகையான இரும்புகள் சூடான Na கரைசல்களில் இரசாயன எதிர்ப்பை அதிகரிக்க உருவாக்கப்பட்டன. Cl மற்றும் அமிலக் கரைசல்களில். எஃகுகளின் எதிர்ப்பை அதிகரிக்க, மாலிப்டினம் மற்றும் தாமிரத்துடன் கூடுதல் கலவை பயன்படுத்தப்படுகிறது, மேலும் இந்த குழுவின் எஃகுகளில் அவர்கள் பெரும்பாலும் ஒரு ஆஸ்டெனிடிக் கட்டமைப்பை பராமரிக்க முயற்சி செய்கிறார்கள், இது தொழில்நுட்ப அடிப்படையில் வசதியானது, இதற்கு நிக்கலுடன் எஃகுகளின் கூடுதல் கலவை தேவைப்படுகிறது. கலப்பு கூறுகளின் அதிக உள்ளடக்கம் காரணமாக, முதன்மையாக நிக்கல், இந்த குழுவின் இரும்புகள் மிகவும் விலை உயர்ந்தவை. குழுவில் உள்ள இரும்புகளின் எடுத்துக்காட்டுகள்: 10 X 17 N 13 M 2 T 08 X 17 N 13 M 3 T, 08 X 17 N 15 M 3 T, 04 X 28 MDT, 03 X 28 MDT, 06 X 28 MT.
அதிகரித்த அரிக்கும் தன்மை கொண்ட சூழலில் பயன்படுத்த இரும்புகள் இந்த வகையான இரும்புகள் சூடான Na கரைசல்களில் இரசாயன எதிர்ப்பை அதிகரிக்க உருவாக்கப்பட்டன. Cl மற்றும் அமிலக் கரைசல்களில். எஃகுகளின் எதிர்ப்பை அதிகரிக்க, மாலிப்டினம் மற்றும் தாமிரத்துடன் கூடுதல் கலவை பயன்படுத்தப்படுகிறது, மேலும் இந்த குழுவின் எஃகுகளில் அவர்கள் பெரும்பாலும் ஒரு ஆஸ்டெனிடிக் கட்டமைப்பை பராமரிக்க முயற்சி செய்கிறார்கள், இது தொழில்நுட்ப அடிப்படையில் வசதியானது, இதற்கு நிக்கலுடன் எஃகுகளின் கூடுதல் கலவை தேவைப்படுகிறது. கலப்பு கூறுகளின் அதிக உள்ளடக்கம் காரணமாக, முதன்மையாக நிக்கல், இந்த குழுவின் இரும்புகள் மிகவும் விலை உயர்ந்தவை. குழுவில் உள்ள இரும்புகளின் எடுத்துக்காட்டுகள்: 10 X 17 N 13 M 2 T 08 X 17 N 13 M 3 T, 08 X 17 N 15 M 3 T, 04 X 28 MDT, 03 X 28 MDT, 06 X 28 MT.
 மிகவும் ஆக்ரோஷமான சூழல்களுக்கான நிக்கல் அடிப்படையிலான உலோகக்கலவைகள் மிக அதிக ஆக்கிரமிப்புத்தன்மை கொண்ட ஊடகங்கள் சல்பூரிக் மற்றும் ஹைட்ரோகுளோரிக் அமிலங்களின் சூடான தீர்வுகளாக விளங்குகின்றன. இத்தகைய ஆக்கிரமிப்பு சூழல்களில், மிகவும் எதிர்ப்பு உலோக பொருட்கள் நிக்கல் அடிப்படையிலான உலோகக் கலவைகள் ஆகும். எடுத்துக்காட்டாக, KhN 65 MV அலாய் சல்பூரிக் மற்றும் ஹைட்ரோகுளோரிக் அமில சூழல்களில், செறிவூட்டப்பட்ட அசிட்டிக் அமிலத்தில் உயர்ந்த வெப்பநிலையில் நிலையாக இருக்கும். அலாய் N 70 MF சல்பூரிக் மற்றும் ஹைட்ரோகுளோரிக் அமிலக் கரைசல்களில் பயன்படுத்த பரிந்துரைக்கப்படுகிறது;
மிகவும் ஆக்ரோஷமான சூழல்களுக்கான நிக்கல் அடிப்படையிலான உலோகக்கலவைகள் மிக அதிக ஆக்கிரமிப்புத்தன்மை கொண்ட ஊடகங்கள் சல்பூரிக் மற்றும் ஹைட்ரோகுளோரிக் அமிலங்களின் சூடான தீர்வுகளாக விளங்குகின்றன. இத்தகைய ஆக்கிரமிப்பு சூழல்களில், மிகவும் எதிர்ப்பு உலோக பொருட்கள் நிக்கல் அடிப்படையிலான உலோகக் கலவைகள் ஆகும். எடுத்துக்காட்டாக, KhN 65 MV அலாய் சல்பூரிக் மற்றும் ஹைட்ரோகுளோரிக் அமில சூழல்களில், செறிவூட்டப்பட்ட அசிட்டிக் அமிலத்தில் உயர்ந்த வெப்பநிலையில் நிலையாக இருக்கும். அலாய் N 70 MF சல்பூரிக் மற்றும் ஹைட்ரோகுளோரிக் அமிலக் கரைசல்களில் பயன்படுத்த பரிந்துரைக்கப்படுகிறது;
 கான்கிரீட்டின் அடர்த்தியை அதிகரித்தல் 4. பாலிமர் சேர்க்கைகளின் அறிமுகம் 4. 1. கான்கிரீட் கலவையில் சிறிய அளவு 0.2 - 3% பாலிமர் சேர்க்கைகளை அறிமுகப்படுத்துதல் (லேடெக்ஸ்கள், பாலிமர் ரெசின்கள்); 4. 2. பாலிமர் பைண்டர் (பாலிமர் தீர்வுகள் மற்றும் பாலிமர் கான்கிரீட்) அடிப்படையில் கான்கிரீட் உற்பத்தி; கேன்களில் உலர்ந்த கலவை மற்றும் கடினப்படுத்துபவராக வழங்கப்படுகிறது. 4. 3. பாலிமர் கலவைகள் அல்லது மோனோமர்களுடன் ஆயத்த கான்கிரீட் மற்றும் வலுவூட்டப்பட்ட கான்கிரீட் தயாரிப்புகளை நேரடியாக கான்கிரீட் உடலில் (கான்கிரீட் பாலிமர்கள்) அவற்றின் அடுத்தடுத்த பாலிமரைசேஷன் மூலம் செறிவூட்டுதல்; 4. 4. பாலிமர் இழைகளுடன் கான்கிரீட் வலுவூட்டல் (ஃபைபர்-வலுவூட்டப்பட்ட கான்கிரீட் உற்பத்தி)
கான்கிரீட்டின் அடர்த்தியை அதிகரித்தல் 4. பாலிமர் சேர்க்கைகளின் அறிமுகம் 4. 1. கான்கிரீட் கலவையில் சிறிய அளவு 0.2 - 3% பாலிமர் சேர்க்கைகளை அறிமுகப்படுத்துதல் (லேடெக்ஸ்கள், பாலிமர் ரெசின்கள்); 4. 2. பாலிமர் பைண்டர் (பாலிமர் தீர்வுகள் மற்றும் பாலிமர் கான்கிரீட்) அடிப்படையில் கான்கிரீட் உற்பத்தி; கேன்களில் உலர்ந்த கலவை மற்றும் கடினப்படுத்துபவராக வழங்கப்படுகிறது. 4. 3. பாலிமர் கலவைகள் அல்லது மோனோமர்களுடன் ஆயத்த கான்கிரீட் மற்றும் வலுவூட்டப்பட்ட கான்கிரீட் தயாரிப்புகளை நேரடியாக கான்கிரீட் உடலில் (கான்கிரீட் பாலிமர்கள்) அவற்றின் அடுத்தடுத்த பாலிமரைசேஷன் மூலம் செறிவூட்டுதல்; 4. 4. பாலிமர் இழைகளுடன் கான்கிரீட் வலுவூட்டல் (ஃபைபர்-வலுவூட்டப்பட்ட கான்கிரீட் உற்பத்தி)

 தொகுதி 7. மின் வேதியியல் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாக்கும் முறைகள். விரிவுரை 7. 3 அரிப்பிலிருந்து உலோகங்களின் மின் வேதியியல் பாதுகாப்பு கத்தோடிக் பாதுகாப்பு என்பது ஒரு அரிக்கும் கட்டமைப்பின் உலோகத்தின் திறனை தற்போதைய மூலத்தின் எதிர்மறை துருவத்துடன் இணைப்பதன் மூலம் எதிர்மறையான பக்கத்திற்கு மாற்றுவதைக் கொண்டுள்ளது.
தொகுதி 7. மின் வேதியியல் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாக்கும் முறைகள். விரிவுரை 7. 3 அரிப்பிலிருந்து உலோகங்களின் மின் வேதியியல் பாதுகாப்பு கத்தோடிக் பாதுகாப்பு என்பது ஒரு அரிக்கும் கட்டமைப்பின் உலோகத்தின் திறனை தற்போதைய மூலத்தின் எதிர்மறை துருவத்துடன் இணைப்பதன் மூலம் எதிர்மறையான பக்கத்திற்கு மாற்றுவதைக் கொண்டுள்ளது.
 தொகுதி 7. மின் வேதியியல் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாக்கும் முறைகள். விரிவுரை 7. 3 கத்தோடிக் பாதுகாப்பின் அரிப்பு வரைபடம்
தொகுதி 7. மின் வேதியியல் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாக்கும் முறைகள். விரிவுரை 7. 3 கத்தோடிக் பாதுகாப்பின் அரிப்பு வரைபடம்
 தொகுதி 7. மின் வேதியியல் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாக்கும் முறைகள். விரிவுரை 7. 2 பாதுகாப்பு பாதுகாப்பு என்பது தொடர்பில் உள்ள இரண்டு உலோகங்களின் அரிப்பின் பண்புகளை அடிப்படையாகக் கொண்டது. தொடர்பு அரிப்பு கோட்பாட்டின் படி, ஒரு நேர்மறை உலோக M 2 மிகவும் எதிர்மறை உலோக M 1 உடன் தொடர்பு கொள்ளும்போது, M 2 உலோகத்தின் திறன் எதிர்மறையான பக்கத்திற்கு மாறுகிறது, மேலும் அதன் அரிப்பு குறைகிறது அல்லது முற்றிலும் நிறுத்தப்படும்.
தொகுதி 7. மின் வேதியியல் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாக்கும் முறைகள். விரிவுரை 7. 2 பாதுகாப்பு பாதுகாப்பு என்பது தொடர்பில் உள்ள இரண்டு உலோகங்களின் அரிப்பின் பண்புகளை அடிப்படையாகக் கொண்டது. தொடர்பு அரிப்பு கோட்பாட்டின் படி, ஒரு நேர்மறை உலோக M 2 மிகவும் எதிர்மறை உலோக M 1 உடன் தொடர்பு கொள்ளும்போது, M 2 உலோகத்தின் திறன் எதிர்மறையான பக்கத்திற்கு மாறுகிறது, மேலும் அதன் அரிப்பு குறைகிறது அல்லது முற்றிலும் நிறுத்தப்படும்.
 தொகுதி 7. மின் வேதியியல் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாக்கும் முறைகள். விரிவுரை 7. 3 அரிக்கும் சூழலில் செயலிழக்கக்கூடிய உலோகங்களுக்கு மட்டுமே அனோடிக் பாதுகாப்பு பயன்படுத்தப்படுகிறது. வெளிப்புற மின்னோட்ட மூலத்தைப் பயன்படுத்தி செயலில் கரைக்கும் பகுதியிலிருந்து செயலற்ற பகுதிக்கு உலோகத் திறனை மாற்றுவதற்கு இது வருகிறது.
தொகுதி 7. மின் வேதியியல் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாக்கும் முறைகள். விரிவுரை 7. 3 அரிக்கும் சூழலில் செயலிழக்கக்கூடிய உலோகங்களுக்கு மட்டுமே அனோடிக் பாதுகாப்பு பயன்படுத்தப்படுகிறது. வெளிப்புற மின்னோட்ட மூலத்தைப் பயன்படுத்தி செயலில் கரைக்கும் பகுதியிலிருந்து செயலற்ற பகுதிக்கு உலோகத் திறனை மாற்றுவதற்கு இது வருகிறது.
 தொகுதி 7. மின் வேதியியல் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாக்கும் முறைகள். விரிவுரை 7. 3 அனோடிக் பாதுகாப்பின் அரிப்பு வரைபடம்
தொகுதி 7. மின் வேதியியல் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாக்கும் முறைகள். விரிவுரை 7. 3 அனோடிக் பாதுகாப்பின் அரிப்பு வரைபடம்
ரஷ்ய கூட்டமைப்பின் கல்வி மற்றும் அறிவியல் அமைச்சகம். ஏ. ராடின் இரசாயன எதிர்ப்பு பொருட்கள் மற்றும் அரிப்புக்கு எதிரான பாதுகாப்பு பாடநூல் செயின்ட் - பீட்டர்ஸ்பர்க் 2014 1 UDC 546(075) BBK 24.1я7 L 840 Lukanina T. L., Mikhailova I. S., Radin M. A. பொருட்களின் இரசாயன எதிர்ப்பு மற்றும் அரிப்பு பாதுகாப்பு: பாடநூல். கையேடு.− செயின்ட் பீட்டர்ஸ்பர்க்: SPbGTURP, 2014. - 85 பக். இரசாயனத் தொழில் உபகரணங்களின் சிறப்பியல்பு சூழல்கள் மற்றும் நிலைமைகளை கணக்கில் எடுத்துக்கொண்டு, வேதியியல் அரிப்பு, வழிமுறைகள் மற்றும் பல்வேறு வகையான மின்வேதியியல் அரிப்பு ஆகியவற்றின் வெப்ப இயக்கவியல் மற்றும் இயக்கவியல் பற்றிய நவீன யோசனைகளை கையேடு வழங்குகிறது. அரிப்பை எதிர்க்கும் இரும்புகள் மற்றும் உலோகக்கலவைகளை உருவாக்குவதற்கான அறிவியல் கோட்பாடுகள் மற்றும் கட்டமைப்பு பொருட்களை அரிப்பிலிருந்து பாதுகாக்கும் முறைகள் கோடிட்டுக் காட்டப்பட்டுள்ளன. தொழில்நுட்ப பல்கலைக்கழகங்கள் மற்றும் தொழில்நுட்ப சிறப்புகளில் படிக்கும் பீடங்களின் மாணவர்களுக்கு பாடநூல் வழங்கப்படுகிறது. பட்டதாரி மாணவர்கள், இரசாயன நிறுவனங்களின் அறிவியல் மற்றும் பொறியியல் பணியாளர்கள், வடிவமைப்பு மற்றும் ஆராய்ச்சி நிறுவனங்கள் அரிப்பிலிருந்து உலோகங்களைப் பாதுகாப்பதில் ஈடுபட்டுள்ளவர்களுக்கு பயனுள்ளதாக இருக்கும். விமர்சகர்கள்: டாக்டர் செம். அறிவியல், பேராசிரியர். செயின்ட் பீட்டர்ஸ்பர்க் மாநில ITMO வேதியியல் துறை. ஆசிரியர் Slobodov A. A.; பிஎச்.டி. வேதியியல் அறிவியல், இணைப் பேராசிரியர் கரிம வேதியியல் துறை, செயின்ட் பீட்டர்ஸ்பர்க் ஸ்டேட் டெக்னிக்கல் யுனிவர்சிட்டி ஆஃப் துர்க்மெனிஸ்தான், எவ்டோகிமோவ் ஏ.என். பல்கலைக்கழகத்தின் தலையங்கம் மற்றும் பப்ளிஷிங் கவுன்சில் மூலம் கற்பித்தல் உதவியாகப் பரிந்துரைக்கப்படுகிறது. ஆசிரியர் மற்றும் சரிபார்ப்பவர் டி. ஏ. ஸ்மிர்னோவா டெக். ஆசிரியர் L.Ya Titova Templan 2014, pos. 45 ________________________________________________________________________________________________________________________________ 04/14/14 அன்று வெளியீடு 60×84/16 வடிவம். காகித வகை எண். 1. ஆஃப்செட் அச்சிடுதல். அச்சு தாள் 5.5. Uch.-ed தாள்கள் 100 பிரதிகள் பதிப்பு எண். Ivana Chernykh, 4 St. Petersburg State Technological University of Plant Polymers, 2014 Lukanina T. L., Mikhailova I. S., Radin M. A., 2014 2 அறிமுகம் சுற்றுச்சூழலுடன் இரசாயன அல்லது மின் வேதியியல் தொடர்பு காரணமாக பொருட்களின் தன்னிச்சையான அழிவு. அரிப்பு காரணமாக உலோகங்கள் மற்றும் உலோகக்கலவைகளின் அழிவு, உடல் அல்லது சுற்றுச்சூழலுடன் இயந்திர தொடர்பு காரணமாக ஏற்படும் அரிப்பு அல்லது தேய்மானம் போன்ற தன்னிச்சையான அழிவின் பிற வகைகளிலிருந்து வேறுபடுகிறது. பெரும்பாலான உலோகங்கள் மற்றும் உலோகக் கலவைகளுக்கு, இயக்க நிலைமைகளின் கீழ், ஆக்ஸிஜனேற்றப்பட்ட (அயனி) நிலை மிகவும் நிலையானது, அவை அரிப்பின் விளைவாக கடந்து செல்கின்றன. "அரிப்பு" என்ற சொல் லத்தீன் வார்த்தையான "கொரோடெரே" என்பதிலிருந்து வந்தது, அதாவது "அரிப்பது". அரிப்பினால் ஏற்படும் இழப்புகள் பொதுவாக நேரடி மற்றும் மறைமுகமாக பிரிக்கப்படுகின்றன. நேரடி இழப்புகள் பின்வருவனவற்றை உள்ளடக்குகின்றன: - அரிப்புப் பொருட்களாக மாறும் உலோகத்தின் விலை, அத்துடன் தொழில்நுட்ப நிலைமைகளால் வழங்கப்பட்ட தேய்மான காலத்திற்கு முன்பே தோல்வியுற்ற அரிக்கப்பட்ட உபகரணங்களின் விலை. மேலும், ஒரு விதியாக, உற்பத்தி உபகரணங்களின் விலை அது தயாரிக்கப்படும் உலோகத்தின் விலையை விட அதிகமாக உள்ளது; - அரிப்புக்கான கொடுப்பனவுகளின் அதிகரிப்பு, இது உலோக நுகர்வு அதிகரிப்பதற்கு மட்டுமல்லாமல், வடிவமைப்பின் சரிவுக்கும் வழிவகுக்கிறது. எடுத்துக்காட்டாக, அதே வெளிப்புற விட்டம் கொண்ட பைப்லைனுக்கு, உலோகத்தின் அதிகரித்த கொடுப்பனவு பயனுள்ள குறுக்குவெட்டில் குறைவதற்கு வழிவகுக்கிறது, இதன் விளைவாக, குழாயின் செயல்திறன் குறைகிறது; − உலோகம் மற்றும் உலோகம் அல்லாத பூச்சுகள், அரிப்பை எதிர்க்கும் பொருட்கள், தடுப்பான்கள் போன்ற வடிவங்களில் பாதுகாப்பு நடவடிக்கைகளுக்கான செலவுகள் - அரிப்பினால் சேதமடைந்த உபகரணங்களை பழுதுபார்ப்பதற்காக நிறுத்தப்பட்டதன் விளைவாக குறைந்த உற்பத்தி; - விபத்துக்கள், வெடிப்புகள் மற்றும் தீ ஏற்படும் சாத்தியம்; - அரிப்பின் விளைவாக உபகரணங்களின் சுவர்களில் துளைகள் மூலம் தயாரிப்புகளின் கசிவு; 3 - அரிப்பு தயாரிப்புகளின் படிவு விளைவாக குழாய்களின் குறுக்கு பிரிவில் குறைப்பு, இது திரவ ஓட்டத்தின் தேவையான சக்தியை பராமரிக்க கூடுதல் ஆற்றல் நுகர்வு தேவைப்படுகிறது; - அரிப்பு தயாரிப்புகளால் மாசுபடுவதன் விளைவாக தயாரிப்பு தரம் குறைதல். அரிப்பு மற்றும் உலோகப் பாதுகாப்பின் அறிவியல், அரிக்கும் சூழலுடன் உலோகங்கள் மற்றும் உலோகக் கலவைகளின் தொடர்புகளைப் படிக்கிறது, இந்த தொடர்புகளின் பொறிமுறையையும் அதன் பொதுவான கொள்கைகளையும் நிறுவுகிறது. உலோகங்களின் அரிப்பு மற்றும் பாதுகாப்பு பற்றிய ஆய்வுக்கான அறிவியல் அடிப்படையானது உலோக அறிவியல் மற்றும் இயற்பியல் வேதியியல் ஆகும். இந்த அறிவியலின் இறுதி நடைமுறை இலக்கு உலோகங்கள் அவற்றின் செயலாக்கம் மற்றும் உபகரணங்களின் செயல்பாட்டின் போது அரிக்கும் அழிவிலிருந்து பாதுகாப்பதாகும். அத்தியாயம் 1. அரிப்பைப் பற்றிய பொதுவான தகவல் 1.1. அரிப்பு செயல்முறைகளின் வெப்ப இயக்கவியல் மற்றும் இயக்கவியல், கொடுக்கப்பட்ட வெளிப்புற நிலைமைகளின் கீழ் பல்வேறு சூழல்களில் உள்ள உலோகங்களின் வெப்ப இயக்கவியல் உறுதியற்ற தன்மையே அரிப்புக்கான முதன்மைக் காரணம். அரிப்பு செயல்முறையின் தன்னிச்சையான நிகழ்வின் அடிப்படை சாத்தியம் வெப்ப இயக்கவியலின் விதிகளால் தீர்மானிக்கப்படுகிறது. எந்தவொரு தன்னிச்சையான செயல்முறையின் நிகழ்வும் இலவச ஆற்றலின் குறைவுடன் சேர்ந்துள்ளது. அரிப்பு செயல்முறைகளின் தன்னிச்சையான நிகழ்வின் சாத்தியக்கூறு ஐசோபரிக்-சமவெப்ப ஆற்றல் ΔG1 இல் ஏற்படும் மாற்றங்களால் மதிப்பிடப்படுகிறது. உலோக ஆக்சிஜனேற்றத்தின் தன்னிச்சையான செயல்முறை - அரிப்பு - ∆G என்றால் சாத்தியமாகும்< 0, то есть знак ―минус‖ означает, что изобарно−изотермический потенциал убывает и свободная энергия системы уменьшается. Наоборот, если ∆G > 0, பின்னர் ஐசோபரிக்-ஐசோதெர்மல் திறனுக்கான பிளஸ் அடையாளம் இலவச ஆற்றலின் அதிகரிப்புக்கு ஒத்திருக்கிறது, இது இந்த எதிர்வினையின் தன்னிச்சையான நிகழ்வின் சாத்தியமற்ற தன்மையைக் குறிக்கிறது. ISOBARIC-ISOTHERMAL POTENTIAL (ΔG) - கிப்ஸ் ஆற்றல், வெப்ப இயக்கவியல் ஆற்றல்களில் ஒன்று, ΔG = ΔН - TΔS க்கு சமம், அங்கு ΔН, ΔS, Т - என்டல்பி, என்ட்ரோபி, அமைப்பின் வெப்ப இயக்க வெப்பநிலை. ΔG என்பது கணினியில் உள்ள துகள்களின் எண்ணிக்கைக்கு விகிதாசாரமாகும். ஒரு துகள் என்று குறிப்பிடப்படுகிறது, இது இரசாயன திறன் என்று அழைக்கப்படுகிறது. பொருள் மற்றும் சுற்றியுள்ள உடல்களுக்கு இடையில் பரிமாற்றம் சாத்தியமாகும் செயல்முறைகளை விவரிக்க ΔG வசதியானது. நிலையான அழுத்தத்தில் நிகழும் ஒரு சமவெப்ப சமநிலை செயல்பாட்டில், இது வெளிப்புற அழுத்த சக்திகளுக்கு எதிரான வேலையைக் கழித்த அமைப்பின் மொத்த வேலையாகும். இது ஐசோபரிக்-ஐசோதெர்மல் திறன் குறைவதற்கு சமம் (அதாவது, அதிகபட்ச பயனுள்ள வேலை). [1 4] இருப்பினும், ஆய்வின் கீழ் உள்ள அமைப்பு சமநிலை நிலையிலிருந்து எவ்வளவு தூரம் உள்ளது மற்றும் தன்னிச்சையான எதிர்வினைக்கு திறன் கொண்டது என்பதை வெப்ப இயக்கவியல் தீர்மானிக்கிறது என்றாலும், இது இந்த செயல்முறையின் வேகத்தைக் குறிக்கவில்லை. அரிப்பு விகிதம் அதன் இயக்கவியல் மூலம் தீர்மானிக்கப்படுகிறது. அரிப்பு செயல்முறைகளின் ஒரு அம்சம் அவற்றின் பன்முகத்தன்மை ஆகும். உலோக-திரவ, உலோக-எரிவாயு இடைமுகத்தின் வெவ்வேறு நிலைகளைக் கொண்ட இரண்டு கட்டங்களுக்கு இடையிலான இடைமுகத்தில் உலோக அழிவு நிகழ்கிறது என்பதே இதற்குக் காரணம். இத்தகைய நிலைமைகளின் கீழ், இரசாயன தொடர்புகளின் இயக்கவியலைத் தீர்மானிக்கும் காரணியானது இரசாயன தொடர்புகளின் வீதம், அல்லது தொடர்பு நிலைகளின் அளவுகளிலிருந்து அரிப்பு தொடர்பு ஏற்படும் இடைமுகத்திற்கு எதிர்வினைகளை வழங்குதல் மற்றும் எதிர் எதிர்விளைவு தயாரிப்புகளை அகற்றுதல். திசையில். முதல் வழக்கில், அரிப்பு விகிதம் இயக்கக் கட்டுப்பாட்டால் தீர்மானிக்கப்படுகிறது, இரண்டாவது - பரவல் கட்டுப்பாடு மூலம். சில சந்தர்ப்பங்களில், அரிப்பு விகிதம் கலப்பு பரவல்-இயக்கக் கட்டுப்பாட்டால் தீர்மானிக்கப்படுகிறது. ஒரு நிலையான செயல்முறைக்கு, இரசாயன எதிர்வினை விகிதம் மற்றும் பரவல் விகிதம் சமமாக இருக்கும். அரிப்பு செயல்முறை பல நிலைகளைக் கொண்டுள்ளது, இது தொடர்ச்சியாக அல்லது இணையாக நிகழலாம். பல தொடர்ச்சியான நிலைகளைக் கொண்ட ஒரு அரிப்பு செயல்முறையின் நிலையான-நிலை மொத்த விகிதம் மெதுவான கட்டத்தின் விகிதத்தால் தீர்மானிக்கப்படுகிறது. செயல்முறையின் தனிப்பட்ட நிலைகள் இணையாக நிகழும்போது, மொத்த அரிப்பு விகிதம் வேகமான கட்டத்தால் தீர்மானிக்கப்படுகிறது. எனவே, நிலைகளில் ஒன்று மற்றொன்றை விட மிக வேகமாக சென்றால், இரண்டாவது நிலை புறக்கணிக்கப்படலாம். 1.2 நிகழ்வின் பொறிமுறையின் படி அரிப்பு செயல்முறைகளின் வகைப்பாடு அரிப்பு செயல்முறைகள் ஏற்படுவதற்கான பல்வேறு வகையான நிலைமைகளைப் பொருட்படுத்தாமல், அவை இரண்டு முக்கிய பண்புகளின்படி வகைப்படுத்தலாம்: - செயல்முறையின் பொறிமுறையின் படி - அரிப்பு அழிவின் தன்மைக்கு ஏற்ப . இரசாயன மற்றும் மின் வேதியியல் அரிப்பு உள்ளன. 5 உலர் வாயுக்கள் (வாயு அரிப்பு) மற்றும் திரவ அல்லாத எலக்ட்ரோலைட்கள் 2 (அல்லாத எலக்ட்ரோலைட்டுகளில் அரிப்பு) ஏற்படுகிறது. ஊடகம் ஒரு எலக்ட்ரோலைட் (உலர்ந்த வாயுக்கள் அல்லது திரவ அல்லாத எலக்ட்ரோலைட்டுகள்) இல்லை என்றால், எலக்ட்ரான்களின் பரிமாற்றம் நேரடியாக குறைக்கும் உலோகம் (சிவப்பு) மற்றும் எலக்ட்ரான்களை ஈர்க்கும் திறன் கொண்ட எலக்ட்ரோநெக்டிவ் உறுப்பு கொண்ட எந்தவொரு பொருளுக்கும் இடையில் நிகழ்கிறது - ஆக்ஸிஜனேற்ற முகவர் (எருது . ஒரு அரிக்கும் ஊடகம் (எலக்ட்ரோலைட் கரைசல்) கொண்ட உலோகம், இதில் உலோக அணுக்களின் அயனியாக்கம் மற்றும் அரிக்கும் சூழலின் ஆக்ஸிஜனேற்ற கூறுகளின் குறைப்பு ஆகியவை ஒரே செயலில் ஏற்படாது மற்றும் அவற்றின் விகிதங்கள் மின்முனை ஆற்றலைப் பொறுத்தது. மின்வேதியியல் அரிப்பு செயல்முறையின் தனித்துவமான அம்சங்கள் பின்வருமாறு: - இரண்டு தனித்தனி செயல்முறைகளின் ஒரே நேரத்தில் நிகழ்வு - ஆக்ஸிஜனேற்றம் (உலோகத்தின் கரைப்பு) மற்றும் குறைப்பு (ஹைட்ரஜனின் பரிணாமம், ஆக்ஸிஜனைக் குறைத்தல், கரைசலில் இருந்து உலோகத்தை விடுவித்தல் போன்றவை); - உலோகக் கரைப்பு செயல்முறை உலோகத்தில் எலக்ட்ரான்களின் திசை இயக்கம் மற்றும் எலக்ட்ரோலைட்டில் உள்ள அயனிகளுடன் சேர்ந்துள்ளது, அதாவது. மின்னோட்டத்தின் நிகழ்வு; - இரண்டாம் நிலை எதிர்வினைகளின் விளைவாக அரிப்பு பொருட்கள் உருவாகின்றன. மின்வேதியியல் அரிப்பின் போது நிகழும் ரெடாக்ஸ் செயல்முறைகள் பின்வரும் எதிர்வினைகளின் வடிவத்தில் வழங்கப்படலாம்: Ме − nē→ Меn+ (அனோடிக் செயல்முறை) (2) n− R(ox) + nē → R (சிவப்பு) (கேதோட் செயல்முறை), (3 ) R(ox) ஒரு ஆக்ஸிஜனேற்ற முகவர்; எலக்ட்ரோலைட்டுகள் அல்லாத பொருட்கள், அவற்றின் நீர் கரைசல்கள் மற்றும் உருகும் மின்னோட்டத்தை கடத்தாது. அவை அயனிகளாக உடைக்காத கோவலன்ட் அல்லாத துருவ அல்லது குறைந்த துருவ பிணைப்புகளைக் கொண்டிருக்கின்றன. வாயுக்கள், திடப்பொருட்கள் (உலோகங்கள் அல்லாதவை) மற்றும் கரிம சேர்மங்கள் (சுக்ரோஸ், பெட்ரோல், ஆல்கஹால்) மின்சாரத்தை கடத்துவதில்லை. 2 6 R n−(சிவப்பு) - ஆக்ஸிஜனேற்ற முகவரின் குறைக்கப்பட்ட வடிவம்; nē - மாற்றப்பட்ட எலக்ட்ரான்களின் எண்ணிக்கை. மின்வேதியியல் அரிப்புக்கு ஒரு எடுத்துக்காட்டு நீரின் செல்வாக்கின் கீழ் இரும்பின் ஆக்சிஜனேற்றம் (துருப்பிடித்தல்) செயல்முறை: Fe − 2ē → Fe2+ (அனோடிக் செயல்முறை - இரும்பின் கரைப்பு) H2O + ½О2 +2ē → 2OH– (கேத்தோட் செயல்முறை - ஆக்ஸிஜனைக் குறைத்தல்) −−−−−−−−−−−−−−−−−−−−- −−−−−−−−−−− − Fe 2+ + 2OH – → Fe(OH)2 (அரிப்புப் பொருட்களின் உருவாக்கம்) எதிர்வினைகள் (2) மற்றும் (3) இணைந்து தொடர்கின்றன, ஆனால் அவற்றின் சொந்த இயக்க விதிகளுக்குக் கீழ்ப்படிகின்றன. இந்த வழக்கில், செயல்முறையின் நிலைத்தன்மையின் நிபந்தனைகளுக்கு இணங்க வேண்டியது அவசியம், அதாவது. உலோக ஆக்சிஜனேற்ற விகிதங்களின் சமத்துவம் மற்றும் ஆக்ஸிஜனேற்ற முகவர் குறைப்பு. இந்த எதிர்வினைகள் புவியியல் ரீதியாக பிரிக்கப்பட்டு மேற்பரப்பின் வெவ்வேறு பகுதிகளில் நடைபெறலாம். நிலைத்தன்மையின் நிலைமைகளில் இருந்து, முழு செயல்முறையின் வீதமும் குறைவதற்கு, ஒருங்கிணைந்த எதிர்வினைகளில் ஒன்றை மெதுவாக்குவது போதுமானது. 1.3 அரிப்பு அழிவின் தன்மைக்கு ஏற்ப அரிப்பு செயல்முறைகளின் வகைப்பாடு உலோகத்தின் அரிப்பு அழிவின் தன்மையின் அடிப்படையில், பொது மற்றும் உள்ளூர் அரிப்பு ஆகியவை வேறுபடுகின்றன. ஜெனரல் அரிப்பு உலோகத்தின் முழு மேற்பரப்பில் பரவுகிறது (படம் 1. - 1.2). 1 2 4 5 7 8 3 6 9 படம். 1. அரிப்பு சேதத்தின் வகைகள் பல அரிப்பு நிகழ்வுகளில் பொது அரிப்பு அடங்கும், உதாரணமாக, உலோகம் எலக்ட்ரோலைட்டுகளுக்கு வெளிப்படும் போது, அரிப்பு பொருட்கள் உலோக மேற்பரப்பில் இருக்காது. எனவே, நைட்ரிக் அமிலத்துடன் தாமிரம், ஹைட்ரோகுளோரிக் அமிலத்துடன் 7 இரும்பு, காஸ்டிக் காரங்களுடன் அலுமினியம், சல்பூரிக் அமிலத்துடன் துத்தநாகம், முதலியனவுடன் தீவிரமான பொது அரிப்பு காணப்படுகிறது. சீரான பொது அரிப்பு என்பது அரிப்பின் மிகக் குறைந்த ஆபத்தான வகைகளில் ஒன்றாகும். அரிப்பு சேதம் காரணமாக உலோகக் கரைப்பு விகிதம், கருவி, கருவி போன்றவற்றின் செயல்பாட்டிற்கான தேவைகளால் நிர்ணயிக்கப்பட்ட தரங்களை மீறுவதில்லை. உலோகம் போதுமான தடிமனாக இருந்தால், குறுக்குவெட்டு (பதற்றம், சுருக்கம்) மீது சீராக விநியோகிக்கப்படும் அழுத்தங்களின் கீழ் கட்டமைப்பின் இயந்திர வலிமையைக் குறைப்பதில் அரிப்பு சிறிய விளைவைக் கொண்டிருக்கிறது. இருப்பினும், பகுதிகள் வளைவு மற்றும் முறுக்குக்கு உட்படுத்தப்படும் போது பொதுவான அரிப்பு ஆபத்தானது, ஏனெனில் இந்த வழக்கில் மிகவும் ஏற்றப்பட்ட அடுக்குகள் அழிக்கப்படுகின்றன. உள்ளூர் அரிப்பு - உலோக மேற்பரப்பின் சில பகுதிகளை மட்டுமே அழிக்கிறது, மீதமுள்ளவை அழிவுக்கு உட்படாது அல்லது அழிவின் விகிதம் மிகக் குறைவு. உள்ளூர் அரிப்பின் வெளிப்பாடுகள் மிகவும் வேறுபட்டவை மற்றும் மாறுபட்ட அளவிலான சமச்சீரற்ற தன்மையைக் கொண்டிருக்கலாம், எனவே உள்ளூர் அரிப்பு கறை, புண்கள், பானைகள் (பிட்டிங்), தேர்ந்தெடுக்கப்பட்ட அரிப்பு, அரிப்பு, அரிப்பு வெடிப்பு ஆகியவற்றால் அரிப்பு என பிரிக்கப்பட்டுள்ளது. புள்ளிகள், புண்கள், புள்ளிகள் மூலம் INTERCYSTALLITE அரிப்பு - உள்ளூர் அரிப்பு வகைகள் அழிக்கப்பட்ட பகுதியின் விட்டம் அதன் ஆழத்திற்கு விகிதத்தில் வேறுபடுகின்றன (படம் 1., 4-6). ஸ்பாட் அரிப்புடன், அழிக்கப்பட்ட பகுதியின் விட்டம் அதன் ஆழத்தை விட அதிகமாக உள்ளது, அல்சரேட்டிவ் அழிவுடன், அழிக்கப்பட்ட பகுதியின் விட்டம் அதன் ஆழத்துடன் ஒத்துப்போகிறது, மேலும் குழி அரிப்புடன், அழிக்கப்பட்ட பகுதியின் விட்டம் அதன் ஆழத்தை விட மிகக் குறைவு. . சில சந்தர்ப்பங்களில், குழி அரிப்பு அழிவின் மூலம் ஏற்படலாம், இது குழாய் இணைப்புகள், தொட்டிகள் போன்றவற்றுக்கு குறிப்பாக ஆபத்தானது. செயலிழக்கச் செய்யும் திறன் கொண்ட உலோகங்களுக்கு குழி அரிப்பு பொதுவானது - பிரேக்கிங் (குரோம், அலுமினியம், துருப்பிடிக்காத இரும்புகள் போன்றவை). உலோகங்களின் செயலற்ற நிலை மேற்பரப்பின் சில பலவீனமான பகுதிகளில் சீர்குலைக்கப்படலாம், எடுத்துக்காட்டாக ஒரு பாதுகாப்பு படத்தின் துளைகளில், இண்டர்மெட்டாலிக் சேர்க்கைகள் (ஆக்சைடுகள், கசடுகள், முதலியன) இடங்களில். தேர்ந்தெடுக்கப்பட்ட அரிப்பு - பிரிக்கப்பட்டுள்ளது: கூறு-தேர்ந்தெடுக்கப்பட்ட (தேர்ந்தெடுக்கப்பட்ட) அல்லது கட்டமைப்பு-தேர்ந்தெடுக்கப்பட்ட (இடைப் படிக). 8 பாகங்கள்-தேர்ந்தெடுக்கும் அரிப்புக்கு ஒரு உதாரணம் பித்தளையின் வடிகால் நீக்கம் ஆகும். துத்தநாகம் தாமிரத்தை விட மின்பகுளிக்குள் (பொதுவாக நடுநிலை அல்லது சற்று அமிலத்தன்மை கொண்ட pH மதிப்பில்) அதிக தீவிரத்துடன் செல்கிறது என்பதை பித்தளை 3 இன் டிஜின்சிஃபிகேஷன் கொண்டுள்ளது. பித்தளையின் மேற்பரப்பில் தாமிரத்தின் ஒரு தளர்வான அடுக்கு உருவாகிறது, இது மின் வேதியியல் அரிப்பை அதிகரிக்க உதவுகிறது (மைக்ரோகால்வனிக் கலத்தின் தோற்றம்). STRUCTURAL-SELECTIVE அரிப்புக்கு ஒரு உதாரணம் சாம்பல் வார்ப்பிரும்பு அரிப்பு. சாம்பல் வார்ப்பிரும்புகளின் கட்டமைப்பு தேர்ந்தெடுக்கப்பட்ட அரிப்பு ஃபெரைட் கூறுகளின் முக்கிய அழிவைக் கொண்டுள்ளது, இதன் விளைவாக அரிப்பு தயாரிப்புகளால் நிரப்பப்பட்ட கிராஃபைட் எலும்புக்கூட்டை உருவாக்குகிறது (படம் 1-3). அதே நேரத்தில், வார்ப்பிரும்பு இயந்திர வலிமை கூர்மையாக குறைகிறது. இண்டர்கிரிஸ்டலைட் அரிப்பு என்பது தானிய எல்லைகளுடன் உலோகத்தின் தேர்ந்தெடுக்கப்பட்ட அழிவால் வகைப்படுத்தப்படுகிறது (படம் 1-7). இதன் விளைவாக, வெகுஜன மற்றும் தோற்றத்தில் ஒரு சிறிய மாற்றத்துடன், உலோகத்தின் வலிமை பண்புகளின் மிகவும் குறிப்பிடத்தக்க இழப்பு ஏற்படலாம் (படம் 2). 40 படம். 2. பல்வேறு வகையான அரிப்பு அழிவின் போது உலோகத்தின் வலிமை பண்புகள் இழப்பு 1 - சீரான அரிப்பு; 2 – intergranular corrosion 20 w இழப்பு, % 60 2 0 1 2 4 எடை இழப்பு, kg/cm2 தீவிர நிகழ்வுகளில், நுண்ணிய துருப்பிடிப்பின் விளைவாக தானிய எல்லைகள் முழுமையாக அழிந்து, அலாய் பொடியாக நொறுங்கலாம். அரிப்பு கிராக்கிங் என்பது உள்ளூர் அரிப்பு ஆகும், இதில் மிகப்பெரிய இழுவிசை அழுத்தத்திற்கு செங்குத்தாக உள்ள திசையில் அழிவு ஏற்படுகிறது (படம் 1 - 8). 3 பித்தளை - செம்பு-துத்தநாக கலவை. 9 இந்த வழக்கில் ஒரு அரிப்பு விரிசல் தானிய எல்லைகளில் பரவுகிறது அல்லது படிக உடலை வெட்டலாம். அரிப்பு களைப்பிலிருந்து அழிவு (ஒரே நேரத்தில் அரிக்கும் சூழல் மற்றும் மாற்று அல்லது சுழற்சி சுமைகளுடன்) அரிப்பு விரிசல் போது அதே முறையில் தொடர்கிறது. மேற்பரப்பு அரிப்பு, மேற்பரப்பிலிருந்து தொடங்கி, மேற்பரப்பிற்கு அடியில் முக்கியமாக பரவுகிறது, இது பெரும்பாலும் உலோகத்தின் சிதைவு மற்றும் வீக்கத்திற்கு வழிவகுக்கிறது (படம் 1-9), எடுத்துக்காட்டாக, பொறிக்கும் செயல்பாட்டின் போது குறைந்த தரமான தாள் உலோகத்தில் குமிழ்கள் உருவாகின்றன. அல்லது கப்பல்கள் மற்றும் கருவிகளின் செயல்பாட்டின் போது அரிப்பு. 1.4 அரிப்பு குறிகாட்டிகள் அரிப்பு விகிதத்தை அளவிட, அரிப்பு குறிகாட்டிகள் பயன்படுத்தப்படுகின்றன: MASSOMETRIC, VOLUMETRIC, DEPTH, MECHANICAL, CURRENT. 2 மாசோமெட்ரிக் அரிப்பைக் குறியீடு (கிமீ, ஜி/மீ ∙எச்) என்பது மாதிரியின் ஒரு யூனிட் மேற்பரப்பு (கள்) மற்றும் ஒரு யூனிட் நேரத்திற்கு அரிப்பின் விளைவாக உலோகத் திணிப்பில் ஏற்படும் மாற்றமாகும். ஒரு மாதிரியின் வெகுஜனத்தில் ஏற்படும் மாற்றம் பொதுவாக சோதனைக்கு முன் மாதிரியின் வெகுஜனத்திற்கும் (mо) மற்றும் சோதனைக்குப் பிறகு (m1) சோதனைக்குப் பிறகு (τ) அரிப்பு தயாரிப்புகளை அகற்றுவதன் மூலம் (τ) தீர்மானிக்கப்படுகிறது (உலோக நிறை இழப்பு) . K m = (m0 - m1)/s ∙ τ . (4) 3 2 VOLUMETRIC corrosion index (Kν, cm /m h) என்பது ஒரு யூனிட் உலோக மேற்பரப்பு மற்றும் ஒரு யூனிட் நேரத்திற்கு K m = V0/s ∙ τ, அரிப்பு செயல்பாட்டின் போது உறிஞ்சப்படும் அல்லது வெளியிடப்படும் வாயுவின் அளவு (Vo) ஆகும். (5) DEPTH அரிப்புக் குறியீடு (பி, மிமீ/ஆண்டு) அரிப்பு காரணமாக உலோகத் தடிமன் குறைவதைக் கணக்கில் எடுத்துக்கொள்கிறது, இது நேரியல் அலகுகளில் மற்றும் ஒரு யூனிட் நேரத்திற்கு வெளிப்படுத்தப்படுகிறது. வெவ்வேறு அடர்த்திகளுடன் உலோகங்களின் அரிப்பை ஒப்பிடும் போது இந்த காட்டி பயனுள்ளதாக இருக்கும். மாஸ்மெட்ரிக் குறிகாட்டியிலிருந்து ஆழத்திற்கு மாறுவது, சீரான அரிப்பைப் பொறுத்தவரை, P = K m ∙ 8.76 /γ, (6) சூத்திரத்தைப் பயன்படுத்தி, γ என்பது உலோகத்தின் அடர்த்தியாகும். மெக்கானிக்கல் அரிப்பு காட்டி என்பது ஒரு உலோகத்தின் இயந்திர பண்புகளின் முக்கிய குறிகாட்டிகளில் ஒன்றின் மாற்றத்தால் தீர்மானிக்கப்படுகிறது, இது அரிப்பு செயல்முறையின் ஒரு குறிப்பிட்ட நேரத்தில் மற்றும் உறவினர் அலகுகளில் அல்லது சதவீதமாக வெளிப்படுத்தப்படுகிறது. இழுவிசை வலிமையை இயந்திரக் குறிகாட்டியாகப் பயன்படுத்தினால், வலிமை காட்டி (Kσ) இல் ஏற்படும் மாற்றம் Kσ = Δσb/σb, (7) சூத்திரத்தால் தீர்மானிக்கப்படுகிறது, இங்கு σb என்பது அரிப்புக்கு முன் இழுவிசை வலிமையாகும், ∆σb என்பது τ நேரத்தில் அரிப்புக்குப் பிறகு உலோகத்தின் இழுவிசை வலிமையில் மாற்றம். தற்போதைய அரிப்பு காட்டி, ஃபாரடேயின் சூத்திரத்தைப் பயன்படுத்தி, அரிப்பு மின்னோட்டத்தின் அளவு Km = IA /nF, (8) அடிப்படையில் அரிக்கப்பட்ட உலோகத்தின் அளவைக் கணக்கிட அனுமதிக்கிறது, இதில் Km என்பது மாற்றத்தின் அடிப்படையில் அரிப்பு வீதமாகும். உலோக வெகுஜனத்தில்; நான் - தற்போதைய வலிமை; எஃப் - ஃபாரடே மாறிலி; n - உலோக வேலன்ஸ்; A என்பது உலோகத்தின் அணு நிறை. உலோகங்களின் அரிப்பு எதிர்ப்பை தரம் மற்றும் அளவு மதிப்பீடு செய்யும் போது, பத்து-புள்ளி அளவுகோலைப் பயன்படுத்த பரிந்துரைக்கப்படுகிறது4. உலோகங்களின் அரிப்பு எதிர்ப்பை மதிப்பிடுவதற்கான இந்த அளவுகோல் மிகவும் பரவலாகிவிட்டாலும், குறிப்பாக இரசாயனத் தொழிலில், இது உலகளாவியது அல்ல என்பதை கவனத்தில் கொள்ள வேண்டும், ஏனெனில் பல்வேறு நோக்கங்களுக்கான உபகரணங்களுக்கு, அனுமதிக்கப்பட்ட அரிப்பு விகிதங்கள் அளவு அல்லது வரிசையால் வேறுபடலாம். மேலும் அட்டவணை 1 பத்து -உலோகங்கள் மற்றும் உலோகக்கலவைகளின் அரிப்பு எதிர்ப்பின் பாலிக் அளவுகோல் முற்றிலும் நிலைத்திருக்கும், மிகவும் நிலையான எதிர்ப்பு குறைந்த-எதிர்ப்பு நிலையற்ற அரிப்பு வேகம், மிமீ/வருடம் 0.001 க்கு மேல் 0.005 முதல் 0.05 க்கு 0.05 க்கு மேல். 0.1 முதல் 0.1 முதல் 0.5 வரை 0.5 முதல் 1.0 வரை 1.0 முதல் 5.0 வரை 5.0 முதல் 10.0 வரை 10.0 ஸ்கோர் 1 2 3 4 5 6 7 8 9 10 அரிப்பு மற்றும் முதுமைக்கு எதிராக ஒருங்கிணைந்த பாதுகாப்பு அமைப்பு. நிலத்தடி கட்டமைப்புகள். அரிப்பு பாதுகாப்புக்கான பொதுவான தேவைகள். GOST 9.602−2005, http://www.gosthelp.ru/gost/gost206.html 4 11 அத்தியாயம் 2. உலோகங்களின் இரசாயன அரிப்பு வெளிப்புற சூழலுடன் இரசாயன தொடர்பு காரணமாக உலோகங்களின் வேதியியல் அரிப்பு என்பது ஒரு தன்னிச்சையான செயல்முறையாகும். இரசாயன அரிப்பு செயல்முறையின் தனித்துவமான அம்சங்கள் பின்வருமாறு: - ஒரு கட்டத்தில் ஆக்சிஜனேற்றம் மற்றும் குறைப்பு செயல்முறைகளை செயல்படுத்துதல்; - மின்சாரம் இல்லாதது; - அதன் அழிவு ஏற்படும் மேற்பரப்பில் நேரடியாக அரிப்பு தயாரிப்புகளின் உருவாக்கம். இரசாயன அரிப்பு என்பது திரவம் (எல்) அல்லது வாயு கட்டம் (ஜி) - உலோகம் - உலோகம் மற்றும் 2 வகைகளாக பிரிக்கப்பட்டுள்ளது (எரிவாயு அரிப்பு, திரவ அல்லாத எலக்ட்ரோலைட்டுகளில் அரிப்பு). 2.1 வாயு அரிப்பு நடைமுறையில், இது மிகவும் முக்கியத்துவம் வாய்ந்த வாயு அரிப்பு ஆகும். பெரும்பாலும், இது ஆக்ஸிஜன் கொண்ட வாயுக்களின் வளிமண்டலத்தில் அதிக வெப்பநிலையில் (தண்ணீரின் கொதிநிலையை விட பல்லாயிரம் மடங்கு அதிகமாக) உலோகப் பொருட்களின் அரிப்பை வெளிப்படுத்துகிறது. இந்த காரணத்திற்காக, இது உயர் வெப்பநிலை அரிப்பு அல்லது உயர் வெப்பநிலை ஆக்சிஜனேற்றம் என்று அழைக்கப்படுகிறது. உலோகங்கள் மற்றும் உலோகக்கலவைகளால் செய்யப்பட்ட பொருட்களின் மேற்பரப்பில், அத்தகைய அரிக்கும் சூழலுடன் அவற்றின் தொடர்புகளின் விளைவாக, பல்வேறு உலோக ஆக்சைடுகளைக் குறிக்கும் தயாரிப்புகளின் படம் உருவாகிறது. அதே நேரத்தில், இயக்க நிலைமைகளைப் பொறுத்து, பிற கலவைகள் உருவாகலாம், எடுத்துக்காட்டாக, சல்பர் உலோகங்கள்5. எடுத்துக்காட்டாக, எண்ணெய் சுத்திகரிப்புத் தொழிலில், வாயு அரிப்பு பாதிக்கிறது, எடுத்துக்காட்டாக, உலை குழாய்கள், உலை சுவர்கள், எதிர்வினை நெடுவரிசைகள் மற்றும் ஹைட்ரஜன் சல்பைட், கார்பன் மோனாக்சைடு, நைட்ரஜன், ஆக்ஸிஜன் மற்றும் பிற வாயுக்களுக்கு அதிக வெப்பநிலையில் வெளிப்படும் பிற உபகரணங்கள். "வாயு அரிப்பு" என்பது அதிக வெப்பநிலையில் நீராவிகள் மற்றும் வாயுக்களின் செயல்பாட்டினால் ஏற்படும் உலோகங்களின் அழிவைக் குறிக்கிறது, இருப்பினும் இது சல்பைடுகளைப் போலவே 5 கந்தக உலோகங்களில் குறைந்த வெப்பநிலையிலும் பயன்படுத்தப்படலாம். 12 மின்னோட்டத்தை கடத்தும் திரவப் படலம் உலோகத்தின் மீது ஒடுங்காமல் இருப்பதை உறுதி செய்கிறது. உலோகங்கள் மற்றும் உலோகக் கலவைகளால் செய்யப்பட்ட பொருட்களின் மேற்பரப்பில், ஒரு அரிக்கும் சூழலுடன் அவற்றின் தொடர்புகளின் விளைவாக, பல்வேறு உலோக சேர்மங்களைக் குறிக்கும் தயாரிப்புகளின் படம் உருவாகிறது. பொதுவாக, இரசாயன அரிப்பு செயல்முறையை விவரிக்கலாம், எடுத்துக்காட்டாக, சூடான (T >>373K) வாயு (G2) உடன் உலோக ஆக்சிஜனேற்றத்தின் எதிர்வினை மூலம்: 2Ме + nГ2 → 2Men+Гn. ஒரு ஆக்ஸிஜன் சூழலில், அத்தகைய செயல்முறையை பின்வரும் சமன்பாடு Me(T) + ½ O2 ↔ MeO(T) மூலம் விவரிக்கலாம். இந்த எதிர்வினை அதிக வெப்பநிலையில் சமநிலையில் இருக்கும். தலைகீழ் செயல்முறை ஆக்சைடு விலகல் என்று அழைக்கப்படுகிறது. வாயு சூழலில் இருக்கும் ஆக்ஸிஜன் அதன் பகுதி அழுத்தம் (pO2) மூலம் வகைப்படுத்தப்படுகிறது. உலோக ஆக்சிஜனேற்றத்தின் இரசாயன எதிர்வினை ஆக்ஸிஜனின் பகுதி அழுத்தம் (pO2) மற்றும் ஆக்சைடு விலகலின் நெகிழ்ச்சி (pMeO) 7 ஆகியவை சமமாக மாறினால், ஆக்சைடு விலகல் எதிர்வினையுடன் சமநிலையில் இருக்கும். முக்கியமாக ஆக்சைடு உருவாகும் திசையில். pMeO > pO2 போது எதிர்வினை முக்கியமாக எதிர் திசையில் செல்கிறது. உலோகங்களின் ஆக்சிஜனேற்றம் என்பது பல-நிலை பன்முக செயல்முறையாகும், இதன் காரணமாக முதலில் ஒரு மோனோ- பின்னர் ஒரு பாலிமோலிகுலர் ஆக்சைடு அடுக்கு, ஆக்சைடு படம் என்று அழைக்கப்படுகிறது, இது மேற்பரப்பில் உருவாகிறது. அதன் தடிமன் வளர்ச்சி இரண்டு திசைகளிலும் ஒரே நேரத்தில் (உலோகம் மற்றும் வாயு ஊடகம்), அல்லது முக்கியமாக ஒன்றில் (படம் 3) ஏற்படலாம். பகுதி அழுத்தம் (லேட் லத்தீன் பகுதியிலிருந்து - பகுதியளவு), ஒரு வாயு கலவையில் சேர்க்கப்படும் ஒரு வாயு ஒரே வெப்பநிலையில் கலவையின் அளவிற்கு சமமான அளவை ஆக்கிரமித்தால் அது கொண்டிருக்கும் அழுத்தம். 7 ஆக்சைடுகளின் உருவாக்கம் அல்லது வெப்ப விலகல் எதிர்வினைகளுக்கான ஆக்ஸிஜனின் சமநிலை பகுதி அழுத்தம் ஆக்சைடு விலகல் நெகிழ்ச்சி என்று அழைக்கப்படுகிறது. அதன் மதிப்பு எதிர்வினையின் சமநிலை மாறிலியுடன் தொடர்புடையது, எனவே, வெப்பநிலையின் செயல்பாடாகும். 6 13 a b c படம். படம் 3. ஒரு உலோகப் பகுதியின் மேற்பரப்பில் ஒரு ஆக்சைடு படத்தின் உருவாக்கம் மற்றும் வளர்ச்சியின் அயனி-மின்னணு பொறிமுறையின் திட்டம், ஒரு வாயு ஊடகத்தின் திசையில் வளர்ச்சி ஏற்பட்டால், பகுதியின் அளவு குறிப்பிடத்தக்க அதிகரிப்பு காணப்படுகிறது , எடுத்துக்காட்டாக, ஆக்ஸிஜனேற்றத்தின் போது, இது இயந்திர பொறியியலில் கணக்கில் எடுத்துக்கொள்ளப்பட வேண்டும். ஆக்சைடு படலத்தில் உள்ள உலோக அயனிகள் Мen+ மற்றும் ஆக்ஸிஜன் O2− ஆகியவற்றின் எதிர் பரவல் விகிதங்களுக்கு இடையிலான விகிதத்தால் வளர்ச்சியின் திசை தீர்மானிக்கப்படுகிறது. உலோக அயனிகள் (rdif.Me) மற்றும் ஆக்ஸிஜன் (rdif.O2) ஆகியவற்றின் பரவல் விகிதங்கள் மிகவும் வேறுபட்டால், ஆக்சைடு படத்தின் வளர்ச்சி முக்கியமாக ஒரு திசையில் நிகழ்கிறது, எடுத்துக்காட்டாக, rdiff.O2 உடன்< rдиф.Mе − в направлении газовой среды и наоборот (рис. 3, в, б). В большинстве случаев, скорости диффузии ионов металла и кислорода соизмеримы, но для ионов кислорода скорость несколько ниже из−за того, что они больше по размерам, поэтому зона роста, находящаяся в толще самой оксидной пленки, располагается ближе к ее внешней поверхности (рис. 3, а). По мере утолщения оксидной пленки процессы встречной диффузии ионов и электронов затрудняются. С повышением температуры упругость диссоциации оксидов возрастает у всех металлов. Поэтому, начиная от какой−то температуры, когда упругость диссоциации оксида металла становится больше парциального давления кислорода в воздухе (при атмосферном давлении рО2 = 0,21 ат), металл перестает окисляться и становится вполне малоактивным по отношению к кислороду. Так, например, серебро при температуре 300 ºК термодинамически еще не устойчиво, а при 400 ºК и при всех более высоких температурах упругость диссоциации Ag2O превышает парциаль14 ное давление кислорода в воздухе. При температуре 2000 ºК медь тоже становится неокисляемым металлом, однако для таких металлов, как Fе, Zn, Ni и др., даже при этих температурах упругость диссоциации окислов остается еще достаточно низкой и, следовательно, протекание реакции окисления вероятно. Необходимо учесть, что температурная зависимость для кинетики процесса окисления совершенно иная, чем для термодинамической вероятности окисления. Поэтому нет никакого противоречия в том, что термодинамическая вероятность окисления металла с повышением температуры падает, а реальная скорость окисления (при условии, что термодинамически этот процесс остается еще возможным) с повышением температуры возрастает. 2.2. Образование тонких пленок на металлах Ранее было отмечено, что в большинстве случаев образовавшиеся продукты газовой коррозии – оксиды металла остаются на поверхности металла в виде пленки. Эти пленки определяют кинетику процесса и в случае наличия защитных свойств могут привести к замедлению коррозии. Чтобы пленка оксида металла обладала защитными свойствами, она должна быть: − сплошной; − прочно сцепляться с основным металлом и обладать близким к нему коэффициентом теплового расширения; − быть химически инертной по отношению к данной агрессивной среде; − обладать твердостью и износостойкостью. Даже при обычной температуре на поверхности многих металлов и сплавов на воздухе образуются слои оксидов. Еще в 1836 г. М. Фарадей высказал предположение, что даже на блестящей поверхности металлов существует тончайшая, невидимая защитная (оксидная) пленка. Этим он объяснял пассивность железа в азотной кислоте. Если пленка пористая, рыхлая и характеризуется плохим сцеплением с основным металлом, то даже при условии инертности в данной агрессивной среде, она не будет обладать защитными свойствами. Пленки по толщине (δ) делятся на три группы: − тонкие (невидимые), δ < 4000 нм; − средние (дающие цвета побежалости), δ = от 4000 до 50000 нм; 15 − толстые (видимые), δ > 50000 நா.மீ. உலர் காற்றுடன் உலோகத்தின் தொடர்புகளின் போது உருவாகும் படங்களின் தடிமன் வேறுபட்டது மற்றும் உலோக வகை, வெப்பநிலை மற்றும் பிற காரணிகளைப் பொறுத்தது. எனவே, அறை வெப்பநிலையில் செம்பு மற்றும் இரும்பு மீது படங்களின் தடிமன் 100-300 nm, மற்றும் அலுமினியம் 1000-1500 nm ஆகும். உலோகங்களில் மெல்லிய படலங்கள் இருப்பதை நிரூபிக்கும் பல உதாரணங்களை தருவோம். 1. ஒரு இரும்புத் தகட்டின் சுத்தமான பளபளப்பான மேற்பரப்பை ஒரு முனையில் சூடாக்கும்போது, குறுக்கீடு நிறங்கள் அதில் தோன்றும் - "வண்ணங்களை அழித்துவிடும்". இது பல்வேறு தடிமன் கொண்ட ஆக்சைடுகளின் தோற்றத்தைக் குறிக்கிறது. வண்ணங்கள் பின்வரும் வரிசையில் செல்கின்றன - தட்டின் குளிர்ந்த முனையிலிருந்து முறையே சூடான ஒன்று வரை: மஞ்சள், ஆரஞ்சு, சிவப்பு, ஊதா, ஊதா, நீலம். செப்பு நைட்ரேட் கரைசலின் சொட்டுகளைப் பயன்படுத்தி உருவாக்கப்பட்ட படத்தின் பாதுகாப்பு பண்புகளை சோதிக்கும் போது, படம் பலவீனமான பாதுகாப்பு பண்புகளைக் கொண்ட இடங்களில், அது இரும்புடன் வினைபுரிகிறது: Cu(NO3)2 + Fe → Fe(NO3)2 + Cu. இதன் விளைவாக, சொட்டுகளின் கீழ் மேற்பரப்பில் தாமிரம் தோன்றும். எதிர்வினை நிகழும் நேரத்தில், பல்வேறு பகுதிகளில் உள்ள படங்களின் பாதுகாப்பு பண்புகளை ஒருவர் தீர்மானிக்க முடியும். இந்த சோதனையில், வெப்பமூட்டும் தளத்திலிருந்து (மஞ்சள் மண்டலத்திற்குப் பின்னால்) அமைந்துள்ள பகுதியில் சிறந்த பாதுகாப்பு பண்புகள் காணப்படுகின்றன, அங்கு மேற்பரப்பு மாறாமல் உள்ளது. சூடான பகுதிகளுடன் ஒப்பிடும்போது இந்த பகுதியில் மிகவும் மெல்லிய, ஆனால் அடர்த்தியான படம் உள்ளது என்பது வெளிப்படையானது. 2. பாதரசத்தின் கீழ் ஒரு ஊசியை (அல்லது ரேஸர் பிளேடு) உடைத்தால், உடைந்த புள்ளிகளில் கலவை உருவாகும். உடைந்த மாதிரிகள் பாதரசத்தில் காற்றில் வைக்கப்படும் போது, கலவை கவனிக்கப்படாது. இது ஒரு மிக மெல்லிய ஆக்சைடு படத்தின் உருவாக்கம் மூலம் விளக்கப்படுகிறது, இது கலவையை தடுக்கிறது. 3. அதிகப்படியான அயோடின் கொண்ட பொட்டாசியம் ஹைட்ராக்சைடு கரைசலில் இரும்பை வைக்கும்போது, கரைசலில் இரும்பின் மேற்பரப்பில் ஆழமான கீறல் ஏற்படுகிறது. சிறிது நேரம் கழித்து, கீறல் இடத்தில் உள்ள இரும்பு கரையத் தொடங்குகிறது, மேலும் கண்ணாடியின் அடிப்பகுதியில் செதில்களாக இருக்கும், இது மேலும் பரிசோதனையில் இரும்பு (III) ஆக்சைடாக மாறும். உலோகத்தில் படம் உருவாகும் செயல்முறை நிலைகளில் நிகழ்கிறது. 16 அரிக்கும் சூழலுடன் ஒரு உலோகத்தின் தொடர்பு செயல்முறையின் முதல் நிலை, உலோக மேற்பரப்பில் ஆக்ஸிஜனேற்ற முகவரின் (O2, CO2, H2O, SO2) வேதியியல் உறிஞ்சுதல் ஆகும், எடுத்துக்காட்டாக: Me(sol) + (O2) = Me( சோல்) + 2ஓட்ஸ். உலோகத்திற்கும் ஆக்ஸிஜனேற்ற முகவருக்கும் இடையிலான வேதியியல் தொடர்பு முன்னிலையில், அரிக்கும் சூழலுடன் உலோகத்தின் தொடர்புகளின் இரண்டாம் நிலை உணரப்படுகிறது - வேதியியல் படமானது ஆக்சைடுக்கு மாறுகிறது. xMe(s) + yOads = MexOy: படிவத்தின் எதிர்வினை மூலம் இந்த செயல்முறையை வழக்கமாக விவரிக்க முடியும். உலோகத்தின் மேற்பரப்பில் உருவாகும் ஆக்சைடு படம், ஆக்ஸிஜனேற்ற உலோகத்தின் மேற்பரப்பில் ஆக்ஸிஜனேற்ற முகவர் வழங்கப்படுவதைத் தடுப்பதன் காரணமாக அரிப்பு செயல்முறையை மெதுவாக்கும். இந்த நிலையில், படம் பாதுகாக்கும் பண்புகளைக் கொண்டுள்ளது. 2.2.1. உலோகங்கள் மீதான படங்களின் தொடர்ச்சிக்கான நிபந்தனை தொடர்ச்சியான படங்கள் மட்டுமே பாதுகாப்பு பண்புகளைக் கொண்டிருக்க முடியும். அத்தகைய படம் உருவாகும் சாத்தியம் பில்லிங்-பெட்வொர்த் கன்டினியூட்டி கண்டிஷனால் தீர்மானிக்கப்படுகிறது. உலோக மேற்பரப்பில் (Vok) தோன்றும் சேர்மத்தின் மோலார் அளவு, சேர்மத்தின் ஒரு மோலை உருவாக்க நுகரப்படும் உலோகத்தின் (VMe) அளவை விட அதிகமாக இருக்க வேண்டும்: Vok/VMe >1. Vok/VMe என்றால்< 1, то пленка не может быть сплошной. К металлам, не удовлетворяющим условию сплошности при окислении их кислородом, относятся щелочные и щелочно−земельные металлы. Сплошность пленок – необходимый, но недостаточный фактор, определяющий ее защитные свойства. Как показал Францевич И. Н., у пленок с Vok/VMe >>1 அதிக பாதுகாப்பு பண்புகளை கொண்டிருக்க முடியாது, ஏனெனில் அவற்றில் பெரிய உள் அழுத்தங்கள் ஏற்படுகின்றன (எடுத்துக்காட்டாக, MoO3 அல்லது WO3). தொகுதி விகிதத்தின் மேல் வரம்பு 2.5 ஆக எடுக்கப்படுகிறது. பின்னர் சுத்திகரிக்கப்பட்ட தொடர்ச்சி நிலை இப்படி இருக்கும்: 1< Vok/VMe < 2,5. 2.2.2. Законы роста оксидных пленок на металлах Процесс роста ПОРИСТОЙ ПЛЕНКИ не осложняется процессом подвода окислителя к поверхности металла, а контролируется скоростью химической реакции образования оксида. Скорость коррозии в этом случае выражается уравнением: 17 V = dx/d = kC, где x − толщина пленки; – время; k − константа скорости химической реакции образования оксида; C − концентрация окислителя на поверхности метала. Рост пористой пленки, контролируемый скоростью химической реакции окисления металла, протекает во времени ПО ЛИНЕЙНОМУ ЗАКОНУ. Линейный закон роста имеет место: − при высокотемпературном окислении на воздухе и в среде кислорода при Vok/VMe<1; − в случае образовании летучих оксидов. Сплошные пленки затрудняют проникновение реагентов друг к другу и их рост сопровождается самоторможением процесса. Результирующая скорость этого сложного процесса определяется скоростью самой медленной стадии, т.е. возможны различные варианты контроля течения процесса. 1−й вариант. Скорость коррозии контролируется стадией массопереноса (диффузионный контроль процесса). В этом случае концентрация окислителя на границе раздела Ме – оксидная пленка равна нулю, так как скорость химической реакции весьма велика. Уравнение скорости течения коррозии определяется ПАРАБОЛИЧЕСКИМ ЗАКОНОМ роста оксидной пленки. Параболический закон роста реализуется, в частности, при окислении железа на воздухе при различных температурах. 2−ой вариант. В предыдущем случае С = 0, т.е. накопление окислителя на внутренней поверхности оксидной пленки не происходит. Если учесть возможность кинетического торможения процесса роста оксидной пленки наряду с торможением на стадии массопереноса (диффузионно−кинетический контроль процесса), в этом случае приходим к СЛОЖНО − ПАРАБОЛИЧЕСКОМУ ЗАКОНУ роста оксидной пленки. Рост оксидных пленок по сложно−параболическому закону выполняется: а) при окислении железа в парах воды или в атмосфере СО2; б) при окислении Сo, Сu в атмосфере чистого кислорода; в) при частичном разрушении оксидной пленки. Рост оксидных пленок при диффузионно−кинетическом контроле может быть выражен ТАКЖЕ СТЕПЕННЫМ ЗАКОНОМ. 18 3−й вариант. Часто рост пленки протекает медленнее, чем это следует из параболического закона роста. Это наблюдается при возникновении оксидных пленок при низких температурах (на Сu в О2 при t < 100 оС; на Аl, Тi, Ni, Zn в О2 при t = 300400 оС.) Затухание объясняется либо уплотнением пленок, либо появлением дефектов (пузырей, расслоений). В этих случаях рост толщины пленки протекает в соответствии с логарифмическим законом роста: x = ln(K). 2.3. Термодинамика процесса химической коррозии В качестве примера рассмотрим процесс окисления металла в атмосфере кислорода. Процесс окисления металла может быть представлен реакцией вида: 2Ме + nО2 → Me2n+Оn. Движущая сила процесса коррозии (ДСП) может быть определена с помощью термодинамики. Торможение процесса (ТП) не может быть определено термодинамически, однако с помощью термодинамики можно оценить условия, уменьшающие или исключающие протекание процесса (применение защитных сред, катодная защита, обескислороживание и др.). Независимо от механизма коррозии возможность ее протекания определяется знаком изменения термодинамического потенциала (см. раздел 1.1). Любое изменение энергии системы характеризует переход ее в новое состояние и является мерой стабильности системы: ΔG = GII − GI , где ΔG – энергия, израсходованная на изменение состояния системы, например, на процесс коррозии; GI − энергия системы в исходном состоянии, например, металла в конкретных условиях; G II − энергия системы в новом состоянии, например, прокорродировавшего металла. Рассчитать ΔG можно, вспомнив начало химии8. Величину изобарно-изотермического потенциала можно рассчитать по разности между суммами Δ G продуктов реакции и исходных веществ: GХР = ΔG ni – ΔG mi. (прод. р-ции) (исх. в-в). ΔG - является функцией температуры. Стандартные значения для большинства веществ сведены в справочные таблицы термодинамических величин. Изменение энергии Гиббса в зависимости от температуры учитывается уравнением Гиббса. ΔG Т = ΔН 298 – 298 Δ S 298. ΔG простого вещества = 0. Определить энергию Гиббса для любой химической реакции можно по уравнению ΔG = ΔG + RТ ln К, рассчитав предварительно величину константы равновесия, например, по равновесным концентрациям веществ. При равновесии ΔG=0, поэтому ΔG+RТlnК=0, следова8 19 2.4. Кинетика процесса химической коррозии Хотя термодинамика и дает ответ на вопрос о том, насколько изучаемая система отдалена от состояния равновесия, но ответ на весьма важный практический вопрос о скорости протекания коррозионного разрушения в рамках термодинамики получен быть не может. Рассмотрением этого вопроса и занимается кинетика коррозионных процессов. 2.4.1. Скорость процесса коррозии. Показатели химической коррозии СКОРОСТЬ КОРРОЗИОННОГО процесса может быть представлена в общем виде с помощью уравнения: СКОРОСТЬ КОРРОЗИИ (СК) = ДСП / ТП, где ДСП − движущая сила процесса; ТП − торможение процесса. Скорость химической коррозии определяют количественно по наблюдениям во времени за изменением какой−либо подходящей для этих целей величины, изменяющейся в процессе коррозии. Тогда истинная скорость коррозии металлического материала определяется из выражения: V = dy/d, где y − изменяющаяся в процессе коррозии характеристика свойств материала; − время коррозии. Для количественного выражения скорости коррозионных разрушений на практике пользуются показателями коррозии, являющимися, по сути, отражением СРЕДНЕЙ СКОРОСТИ КОРРОЗИОННОГО разрушения материала: Vср=∆y/∆. Показатели коррозии. 1. ГЛУБИННЫЙ ПОКАЗАТЕЛЬ коррозии: Kn=∆П/∆, где ∆П − глубина (средняя или максимальная) коррозионного разрушения; ∆ − промежуток времени коррозии. 2. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ ТОЛЩИНЫ образующейся на металле пленки продуктов коррозии: Kn= ∆h/∆, где ∆h − изменение толщины образующейся на металле пленки продуктов коррозии. тельно, ΔG = – RТlnК. Данное уравнение позволяет также определить значение константы равновесия химической реакции по величине изобарно-изотермического потенциала. Для определения направления протекания многих химических реакций достаточно оценить знак Δ G. 1). При ΔН 0 , Δ S 0 реакция самопроизвольна (Δ G 0) при Т. 2). При ΔН 0, Δ S 0 реакция обратная (Δ G 0) при любой Т. 3). При ΔН 0, Δ S 0, реакция самопроизвольна (Δ G 0) при любой Т. 4). При ΔН 0, ΔS 0 реакция самопроизвольна (Δ G 0) при Т. 20 3. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ МАССЫ Km=∆m/S∆, где ∆m − изменение массы корродирующего металла; S – площадь поверхности коррозии. 4.ОБЪЕМНЫЙ ПОКАЗАТЕЛЬ КОРРОЗИИ Kv=∆V/S∆, где ∆V − объем газа, выделившегося или поглощенного в процессе коррозии и приведенный к нормальным условиям. 5. МЕХАНИЧЕСКИЙ ПОКАЗАТЕЛЬ КОРРОЗИИ Кs=(∆s/∆)100 %, где ∆s − относительное изменение характеристики механического свойства. 6. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ ЭЛЕКТРИЧЕСКОГО СОПРОТИВЛЕНИЯ KR=(∆R/∆)100 %, где ∆R − относительное изменение электросопротивления образца. 2.4.2. Влияние внешних факторов на химическую коррозию металлов Скорость и характер процесса химической коррозии металлов зависит от ряда факторов. ВНЕШНИМИ ФАКТОРАМИ называют те, которые связаны с составом коррозионной среды и условиями коррозии (температура, давление, скорость перемещения коррозионной среды и т.д.). Температура − мощный внешний фактор коррозии. Характер влияния температуры на скорость окисления металла определяется зависимостью константы скорости реакции окисления (k) и диффузии (D) от температуры. И k = f(T) и D = f(T) описываются одним и тем же уравнением (уравнение Аррениуса): k = k0 exp (−E/RT), (9) где k0 − константа; Е − энергия активации химической реакции. D = D0 exp (−E1/RT), (10) 1 где D0 – константа; Е − энергия активации диффузии. Таким образом, вне зависимости от вида контролирующей стадии процесса окисления с повышением температуры скорость окисления резко возрастает. Колебания температуры, особенно переменный нагрев и охлаждение, увеличивают скорость окисления металла, так как в защитной пленке образуются трещины. Состав газовой фазы. Влияние состава газовой фазы на скорость коррозии металла велико, специфично и изменяется с изменением температуры. В частности, на скорость окисления железа и 21 стали особенно сильно влияют кислород, соединения серы, водяные пары. Приведенные ниже данные свидетельствуют о зависимости увеличения относительной скорости коррозии стали с 0,17 % углерода от состава газовой фазы при 900 оС: Состав газовой фазы Кислород Чистый воздух Чистый воздух + 2 % SO2 Чистый воздух + 5 % H2O Чистый воздух + 5 % SO2+ 5 % H2O % 200 100 118 134 276 Значительное влияние на коррозию сталей и сплавов оказывают продукты горения топлива, содержащие ванадий (например, V2O5). Это соединение находится в золе от сжигания дешевого топлива − мазута, нефтепродуктов. Зола, налипая на металл, увеличивает скорость его коррозии в десятки раз. Причина этому – «ванадиевая коррозия», обусловленная легкоплавкостью V2O5, и его способностью ОФЛЮСОВЫВАТЬ (переводить в жидкое состояние) химические соединения золы и окалины. Пятиокись ванадия участвует в процессе окисления железа: 4Fe + 3V2O5 = 2Fe2O3 + 3V2O3, V2O3 + O2 = V2O5, V2O5 + Fe2O3 = 2FeVO4. Повышение содержания СО в газовой фазе понижет скорость коррозии углеродистых и низколегированных сталей, но при больших количествах СО в газовой фазе может произойти науглероживание поверхности стали. При этом возможны следующие химические реакции: 2CO + O2 = 2CO2, 2CO = Cсаж + CO2. Давление окислителя. Если бы поверхность металла не была покрыта оксидной пленкой, то скорость окисления была бы пропорциональна парциальному давлению окислителя (для двухатомных газов – PГ2). Так как поверхность металла покрыта слоем оксида, то зависимость скорости окисления от величины парциального давления окисляющего газа определяется строением защитной пленки. В то же время при окислении железа при 700 − 950о С скорость окисления не зависит от парциального давления Po2. 22 Скорость движения газовой фазы. Окисление как гетерогенный процесс определяется скоростью подвода и отвода реагентов в зону реакции. Поэтому, чем больше скорость движения потока газа, тем больше и скорость окисления металла. Режим нагрева металла. Влияние режима нагрева металла может быть рассмотрено в зависимости от влияния колебаний температуры. Иначе говоря, переменные нагрев и охлаждение увеличивают скорость окисления ввиду нарушения сохранности защитной пленки. 2.4.3. Влияние внутренних факторов на химическую коррозию металлов ВНУТРЕННИМИ называют факторы, связанные с составом, структурой, внутренними напряжениями в металле, качеством обработки поверхности металла и др. Состав сплава. Применительно к наиболее важным конструкционным сплавам на основе железа для случая газовой коррозии можно отметить следующее. 1. При высоких температурах (более 800оС) с увеличением содержания углерода в стали скорость ее окисления и обезуглероживания уменьшается вследствие более активного образования СО, что снижает окислительный потенциал газовой фазы. 2. Сера фосфор, никель, марганец практически не влияют на скорость окисления железа. 3.Титан, медь, кобальт, бериллий заметно снижают скорость окисления железа. 4. Хром, алюминий, кремний сильно замедляют окисление железа. 5. Ванадий, вольфрам и молибден могут значительно ускорить окисление стали, которое иногда носит катастрофический характер. Структура сплава. Анализ экспериментальных данных свидетельствует о том, что чем меньше в сплаве структурных составляющих, тем выше его жаростойкость. Применительно к сплавам железо – углерод наиболее устойчивой является АУСТЕНИТНАЯ СТРУКТУРА9. Аустенит (γ-фаза) − высокотемпературная гранецентрированная модификация железа и его сплавов. В углеродистых сталях аустенит − это твѐрдый раствор внедрения, в котором атомы углерода входят внутрь элементарной ячейки γ-железа во время конечной термообработки. В сталях, содержащих другие металлы (кроме железа, легированные стали), атомы металлов замещают атомы железа в кристаллической решетке, и возникает твердый раствор замещения. Фаза названа в честь сэра Уильяма Чандлера Робертс-Остина (англ. William Chandler Roberts-Austen, 1843 − 1902). 9 23 Всего различают пять больших групп нержавеющих сталей, определяемых их микроструктурой. Наиболее распространенными являются три: АУСТЕТНИТНЫЕ (AUSTENITIC) − не магнитная сталь с основными составляющими 15−20 % хрома и 5−15 % никеля, который увеличивает сопротивление коррозии. Она хорошо подвергается тепловой обработке и сварке. Обозначается буквой A в начале наименования марки. Именно аустенитная группа сталей наиболее широко используется в промышленности и в производстве элементов крепежа. МАРТЕНСИТНЫЕ (MARTENSITIC) − значительно более твердые, чем аустетнитные стали и могут быть магнитными. Они упрочняются, закалкой и отпуском подобно простым углеродистым сталям и находят применение главным образом в изготовлении столовых приборов, режущих инструментов и общем машиностроении. Больше подвержены коррозии. Обозначаются буквой С. ФЕРРИТНЫЕ (FERRITIC) стали значительно более мягкие чем мартенситные по причине малого содержания углерода. Они также обладают магнитными свойствами. Обозначаются буквой F. Стали с двухфазной АУСТЕНИТНО−ФЕРРИТНОЙ СТРУКТУРОЙ менее устойчивы против окисления. Их меньшая жаростойкость связывается с большей неоднородностью образующейся защитной пленки, что приводит к ее разрушению при росте (неоднородность возникающих внутренних напряжений). Так хромоникелевые стали с однофазной аустенитной структурой более устойчивы против окисления, чем двухфазные: Х12Н12М2Т, Х12Н9Т ведут себя лучше, чем ОХ21Н5МД2Т или 1Х21Н5Т 2]. На жаростойкость10 чугунов кроме их состава влияет и структура. Существенное влияние оказывает форма графитных включений. Так, при шаровидной форме графита стойкость против окисления выше, чем при пластинчатой. Установлено, что предварительная холодная пластичная деформация несколько ускоряет окисление металла вследствие повышения запаса его энергии. Чем тщательнее обработана поверхность металла, тем меньше скорость его окислеЖаростойкость − окалиностойкость, способность металлических материалов противостоять химическому разрушению поверхности под воздействием воздушной или иных газообразных сред при высоких температурах. 10 24 ния, что обусловлено лучшей сохранностью защитных пленок на гладкой поверхности. 2.5. Некоторые случаи газовой коррозии металлов в технологических средах В химической промышленности многие технологические процессы или их определенные стадии протекают в газовой среде в условиях повышенных температур и давлений (рис.4). При температурах от 100 до 200 − 300 °С многие газы не опасны. Химическая активность газов и скорость газовой коррозии металлов сильно возрастают при температурах выше 200 − 300 °С. Так, Cl2 начинает действовать на железные сплавы при Рис. 4. Некоторые случаи газовой температуре > 200 °C, HCl -> தொழில்நுட்பத்தில் உலோகங்களின் அரிப்பு - 300 °C, SO2, NO2, சல்பர் நீராவிகள். > 500 °C. தொழில்நுட்ப வாயு சூழல்களின் நடத்தை மற்றும் தொழில்துறையில் அவற்றின் பரவலான பயன்பாடு ஆகியவற்றின் இந்த அம்சங்கள் உண்மையான நிலைமைகளில் உலோகங்களின் நடத்தை பற்றி இன்னும் விரிவாகக் கருத்தில் கொள்ள வேண்டும். 2.5.1. O2, CO2, H2O நீராவிகளின் வளிமண்டலத்தில் இரும்பு, வார்ப்பிரும்பு மற்றும் எஃகுகளின் அரிப்பு, இரும்பு-கார்பன் கலவைகளில் அதிக வெப்பநிலையில் காற்று ஆக்ஸிஜனின் தாக்கம், அளவு உருவாக்கம், எஃகு டிகார்பரைசேஷன் மற்றும் வளர்ச்சியுடன் இரும்பின் ஆக்சிஜனேற்றத்திற்கு வழிவகுக்கிறது. வார்ப்பிரும்பு. அதிக வெப்பநிலையில் இரும்பின் ஆக்சிஜனேற்றத்தின் விளைவாக, SCALE எனப்படும் அரிப்பு பொருட்களின் அடுக்கு உருவாகிறது. அளவுகோல் ஒரு சிக்கலான அமைப்பைக் கொண்டுள்ளது மற்றும் பல ஆக்சைடுகளை உள்ளடக்கியது: Fe3O4 - MAGNETITE ஒரு சிக்கலான ஸ்பைனல் படிக லேட்டிஸைக் கொண்டுள்ளது; Fe2O3 - HEMATITE ஒரு ரோம்போஹெட்ரல் லேட்டிஸைக் கொண்டுள்ளது; FeO - VUSTIT ஒரு குறைபாடுள்ள படிக லட்டு அமைப்பைக் கொண்டுள்ளது. வுஸ்டைட் 575 oC க்கும் அதிகமான வெப்பநிலையில் உருவாகிறது மற்றும் மெதுவாக குளிர்விக்கும் போது சிதைகிறது: 4FeO Fe3O4 + Fe. 25 575 °C க்கு கீழே, அளவில் எந்த wustite இல்லை மற்றும் Fe3O4 இன் அடுக்கு எஃகு மேற்பரப்பிற்கு நேரடியாக அருகில் உள்ளது. எஃகு ஆக்சிஜனேற்றத்தின் வீதம் (பிரிவு 2.4.1 ஐப் பார்க்கவும்) அதிவேகத்திற்கு (படம் 5) நெருக்கமான சட்டத்தின் படி வெப்பநிலை அதிகரிக்கும் போது அதிகரிக்கிறது மற்றும் ஆயப் பதிவுகளில் - 1/T ஒரு உடைந்த கோட்டால் வெளிப்படுத்தப்படுகிறது, அதன் ஒவ்வொரு முறிவும் சில மாற்றம். எனவே, 575 ºC வெப்பநிலையில், wustite FeO இன் துணை அடுக்கு அளவில் தோன்றுகிறது, இது ஆக்ஸிஜனின் பரவலில் தலையிடாது, இதன் விளைவாக செயல்முறையின் செயல்படுத்தும் ஆற்றல் அதிகரிக்கிறது மற்றும் உலோக ஆக்சிஜனேற்றத்தின் வீதம் அதிகரிக்கிறது. ~ 900 ºС வெப்பநிலையில் வளைவு முறிவு எஃகு அலோட்ரோபிக் மாற்றத்திற்கு ஒத்திருக்கிறது. எஃகு ஆக்சிஜனேற்ற விகிதத்தின் வெப்பநிலை சார்பு மாற்றத்தின் தன்மை, ஆஸ்டெனிடிக் அமைப்பு அதிக வெப்பத்தை எதிர்க்கும் என்பதைக் குறிக்கிறது, இதில் ஆக்சிஜனேற்ற விகிதத்தில் மெதுவான அதிகரிப்பு வெப்பநிலை அதிகரிக்கும் போது காணப்படுகிறது. இரும்புகள் மற்றும் வார்ப்பிரும்புகளில் ஆக்சிஜனேற்றத்துடன், டிகார்பனைசேஷன் செயல்முறை நிகழ்கிறது - ஆக்ஸிஜன் மற்றும் ஆக்ஸிஜன் கொண்ட உலைகளுடன் இரும்பு கார்பைட்டின் தொடர்பு காரணமாக கார்பனில் மேற்பரப்பு அடுக்கு குறைதல் Fe3C+O2→3Fe+CO2 Fe3C+CO2 →3Fe+2CO Fe3C+H2O→3Fe+CO + H2. 26 வாயு சூழலின் கலவை எஃகு மற்றும் வார்ப்பிரும்புகளின் ஆக்சிஜனேற்ற விகிதத்தில் வலுவான செல்வாக்கைக் கொண்டுள்ளது. வாயு அரிப்பில், ஆக்கிரமிப்பு முகவர்கள், எடுத்துக்காட்டாக, குளோரின், சல்பர் கலவைகள், ஆக்ஸிஜன், காற்று, அயோடின் கலவைகள், முதலியன இருக்கலாம். வெவ்வேறு உலோகங்களை நோக்கி அவற்றின் ஆக்கிரமிப்பு ஒரே மாதிரியாக இருக்காது, எனவே, அரிப்பு விகிதம் மாறுபடும். இதனால், 900 டிகிரி செல்சியஸ் வெப்பநிலையில் Fe, Co, Ni இன் ஆக்சிஜனேற்ற விகிதம் H2O → CO2 → O2 → SO2 வரிசையில் அதிகரிக்கிறது. இந்த வழக்கில், உலோகங்கள், இந்த உதிரிபாகங்களின் வளிமண்டலத்தில் உள்ள அரிப்பு விகிதத்தைப் பொறுத்து, ஏறுவரிசையில் அமைக்கப்பட்டிருக்கும்: Ni → Co → Fe. 900 டிகிரி செல்சியஸ் காற்றில் அரிப்பு விகிதம் 100% என்று நாம் கருதினால், 2% SO2 சேர்க்கை இந்த விகிதத்தை 118% ஆகவும், 5% H2O 134% ஆகவும், 2% SO2 + 5% H2O 276% ஆகவும் அதிகரிக்கிறது. 2.5.2. எரிபொருள் எரிப்பு பொருட்களின் செல்வாக்கின் கீழ் அரிப்பு பெரும்பாலான சந்தர்ப்பங்களில் எரிபொருள் எரிப்பு பொருட்கள் (நிலக்கரி, எரிபொருள் எண்ணெய், முதலியன) கணிசமான அளவு கந்தக கலவைகள் (SO2, H2S) மற்றும் V2O5 வடிவத்தில் வெனடியம் உள்ளன, இது ஒரு வலுவான ஆக்ஸிஜனேற்ற முகவர். குறைந்த உருகும் வெனடியம் ஆக்சைடு உலோகப் பரப்பில் உள்ள பாதுகாப்பு அடுக்குடன் தொடர்பு கொள்கிறது, அதை அழித்து வனடேட்டுகளை உருவாக்குகிறது, இது குறைந்த உருகுநிலை Fe2O3 + V2O5 → 2FeVO4 உடன் வெனடியம் ஆக்சைடு V2O5 உடன் eutectics11 ஐ உருவாக்குகிறது. இவ்வாறு, இரும்பு வனாடேட் (FeVO4) உருகும் புள்ளி = 840 °C உள்ளது, மேலும் அதன் உருகுநிலை V2O5 உடன் 625 °C ஆகும்; குரோமியம் வனடேட் CrVO4 இன் உருகுநிலை 810 °C மற்றும் V2O5 உடன் அதன் யூடெக்டிக் 665 °C ஆகும். பின்னர் வனாடேட் 6FeVO4+4Fe→ 5Fe2O3 + 3V2O3 4Fe+ 3V2O5→ 2Fe2O3 + 3V2O3 V2O3+O2→ V2O5 ஆனது உலோகத்தின் ஆக்சிஜனேற்றச் செயல்பாட்டில் தீவிரமாகப் பங்கேற்கிறது, மேலும் V2O5 தன்னைப் பயன்படுத்துவதில்லை. 620 - 700 டிகிரி செல்சியஸ் வெப்பநிலை வரம்பில் செயல்படும் உலை சுருள்கள், ஆதரவுகள் மற்றும் பகிர்வுகளை அதிக அளவில், வெனடியம் அரிப்பு பாதிக்கிறது. யூடெக்டிக் (கிரேக்கத்தில் இருந்து éutektos - எளிதில் உருகும்), ஒரு திரவ அமைப்பு (தீர்வு அல்லது உருகும்), இது திடமான கட்டங்களுடன் சமநிலையில் கொடுக்கப்பட்ட அழுத்தத்தில் உள்ளது, இதன் எண்ணிக்கை அமைப்பின் கூறுகளின் எண்ணிக்கைக்கு சமம். 11 [27] அதே நேரத்தில், உயர் வெப்பநிலை ஹைட்ரஜன் சல்பைட் அரிப்புக்கு ஆளாகாத குரோமியம் மற்றும் குரோமியம்-நிக்கல் ஸ்டீல்களின் அரிப்பு விகிதம் 15 மிமீ/ஆண்டு அடையும். சல்பர் சேர்மங்களின் செல்வாக்கின் கீழ், ஆக்சைடுகளை விட சல்பைடுகளின் படிக லட்டுகளில் அதிக எண்ணிக்கையிலான குறைபாடுகள் காரணமாக இரும்பு-கார்பன் இரும்புகள் தீவிரமான இடைச்செருகல் அரிப்புக்கு உட்பட்டுள்ளன. இது பரவல் செயல்முறைகளின் தீவிரத்திற்கு வழிவகுக்கிறது. எரிப்பு பொருட்களில் கார்பன் மோனாக்சைடு (II) இன் உள்ளடக்கத்தின் அதிகரிப்புடன், கார்பன் மற்றும் குறைந்த அலாய் ஸ்டீல்களின் வாயு அரிப்பு விகிதம் குறிப்பிடத்தக்க அளவில் குறைகிறது. இருப்பினும், அதன் மிக உயர்ந்த செறிவு மேற்பரப்பின் கார்பரைசேஷனுக்கு வழிவகுக்கிறது: 3Fe+2CO→Fe3С+CO2. X40N50 வகையின் அதிக கலப்பு உலோகக் கலவைகள் வெனடியம் அரிப்பை எதிர்க்கும். மாலிப்டினம், டங்ஸ்டன் மற்றும் வெனடியம் கொண்ட எஃகு கலவையை எஃகில் அறிமுகப்படுத்துவதும் நேர்மறையான விளைவைக் கொண்டிருக்கிறது, ஏனெனில் இந்த கலப்பு கூறுகள் V2O5 உருவாவதை ஊக்குவிக்கின்றன. Cu-அடிப்படையிலான உலோகக்கலவைகள் அத்தகைய அரிப்புக்கு மிகவும் எளிதில் பாதிக்கப்படுகின்றன. வெனடியம் அரிப்பு விகிதத்தை குறைக்க, பின்வருபவை தற்போது பயன்படுத்தப்படுகின்றன: - இயக்க வெப்பநிலையை 650 °C வரை கட்டுப்படுத்துகிறது; - X40N50 வகையின் உலோகக் கலவைகளைப் பயன்படுத்தி, இந்த வகை அழிவுக்கு உட்பட்ட கூறுகளை உருவாக்குதல்; - மெக்னீசியம் மற்றும் அலுமினியம் ஆக்சைடுகளைக் கொண்ட டோலமைட் தூசி எரிபொருளில் வீசுகிறது, இது வெனடியம் ஆக்சைடுடன் பயனற்ற கலவைகளை உருவாக்குகிறது; எரிபொருளில் சோடியம் மற்றும் வெனடியத்தின் மொத்த உள்ளடக்கத்தை 2 10-4%க்கு மிகாமல் கட்டுப்படுத்துகிறது. 2.5.3. குளோரின் மற்றும் ஹைட்ரஜன் குளோரைட்டின் சூழலில் அரிப்பு வாயு குளோரின் மற்றும் ஹைட்ரஜன் குளோரைடு சூழலில் உலோகங்களின் நடத்தை மற்ற ஆக்கிரமிப்பு சூழல்களின் செயல்பாட்டிலிருந்து அடிப்படையில் வேறுபட்டது. உலோகத்தின் மேற்பரப்பில் உருவாகும் குளோரைடு உப்புகள் குறைந்த உருகுநிலையைக் கொண்டிருப்பதே இதற்குக் காரணம், மேலும் சில சமயங்களில் வெப்பநிலை உயரும் போது அவை பதங்கமடைகின்றன, எடுத்துக்காட்டாக Ti + 2Cl2 → TiCl4. ஊக்குவித்தல் - (இணைச்சொல்) ஓட்டுதல், ஊக்குவித்தல், இயக்குதல். பதங்கமாதல் என்பது ஒரு திடப்பொருளில் இருந்து வாயு நிலைக்கு மாறுவது, திரவ கட்டத்தை கடந்து செல்கிறது; பதங்கமாதல் போன்றே. 12 13 28 இந்த எதிர்வினைகளில் பெரும்பாலானவை வெப்பமண்டலமாகும். வெப்பத்தை அகற்றும் வீதம் எதிர்வினையின் விகிதத்தை விட குறைவாக இருக்கும், இதன் விளைவாக குளோரின் வளிமண்டலத்தில் உலோகங்கள் பற்றவைத்து "எரிகின்றன". இது வெப்பநிலையில் குறிப்பிடத்தக்க உள்ளூர் அதிகரிப்புக்கு வழிவகுக்கிறது, இதன் விளைவாக குளோரைடுகள் உருகி சிதைகின்றன. குளோரின் மிகவும் எதிர்க்கும் நிக்கல், ஈயம் மற்றும் குரோம் இரும்புகள். உலர் குளோரின் வளிமண்டலத்தில் சில உலோகங்களின் பற்றவைப்பு வெப்பநிலை: o t பற்றவைப்பு. Ti உடன்< 20 Pb 90−100 Fe 150 Cu 200 Ni > 500. அறை வெப்பநிலையில் உலர்ந்த ஹைட்ரஜன் குளோரைடில், பல உலோகங்கள் மற்றும் உலோகக் கலவைகள் திருப்திகரமான எதிர்ப்பைக் கொண்டுள்ளன. அதிகரிக்கும் வெப்பநிலையுடன், உலோகப் பொருட்களின் எதிர்ப்பு படிப்படியாக ஒவ்வொரு உலோகத்திற்கும் குறிப்பிட்ட வெப்பநிலைக்கு குறைகிறது. உலர் குளோரின் மற்றும் ஹைட்ரஜன் குளோரைடில் உலோகங்கள் மற்றும் உலோகக் கலவைகளின் நீண்ட கால செயல்பாட்டின் போது அனுமதிக்கப்பட்ட அதிகபட்ச உயர் வெப்பநிலை அட்டவணையில் கொடுக்கப்பட்டுள்ளது. 2. உலர் குளோரின் மிகவும் எதிர்ப்பு உலோகங்கள், உன்னத உலோகங்கள் தவிர, நிக்கல் மற்றும் அதன் கலவைகள் உள்ளன. நிக்கல் மற்றும் குரோமியம்-நிக்கல் ஸ்டீல்களில் உருவாகும் மேற்பரப்பு படங்கள் குறைந்த நிலையற்ற தன்மை மற்றும் திருப்திகரமான பாதுகாப்பு பண்புகளைக் கொண்டுள்ளன. அட்டவணை 2 ஹைட்ரஜன் குளோரைடு மற்றும் குளோரின் வளிமண்டலத்தில் சில உலோகங்கள் மற்றும் உலோகக்கலவைகளை இயக்கும்போது அனுமதிக்கப்பட்ட வெப்பநிலைகள்3] T, °C பொருள் Cl2 1200 - − 550 - 100 150 300 - பிளாட்டினம் தங்க டங்ஸ்டன் நிக்கல், 80% 6% Fe) காப்பர் கார்பன் ஸ்டீல் St.Z துருப்பிடிக்காத எஃகு 12Х18Н9Т வெள்ளி 29 HCl 1200 870 600 510−600 480 100−120 260−350 450−020.52.3020. எஃகு ஹைட்ரஜன் அரிப்பு ஹைட்ரஜன் அரிப்பு ஹைட்ரஜன் கொண்ட சூழலில் 200 ° C மற்றும் 300 MPa இருந்து அழுத்தத்தில் இருந்து உயர்ந்த வெப்பநிலையில் நிகழும் பல தொழில்நுட்ப செயல்முறைகளுடன் சேர்ந்து கொள்ளலாம். இந்த நிலைமைகள் நிலக்கரி மற்றும் எண்ணெயின் ஹைட்ரஜனேற்றம், அம்மோனியா மற்றும் மெத்தனால் ஆகியவற்றின் தொகுப்பு போன்ற செயல்முறைகளுக்கு ஒத்திருக்கிறது. ஹைட்ரஜனால் இரண்டு வகையான உலோக சேதங்கள் காணப்படுகின்றன - ஹைட்ரஜன் உடையக்கூடிய மற்றும் ஹைட்ரஜன் அரிப்பு. பெரும்பாலும் இந்த நிகழ்வுகள் ஒன்றுடன் ஒன்று ஒன்றுடன் ஒன்று. வாயுவில் அம்மோனியா இருந்தால், உலோகத்தின் நைட்ரைடேஷன் கூட ஏற்படலாம். ஒரு நைட்ரஜன்-ஹைட்ரஜன் கலவையானது உயர்ந்த வெப்பநிலை மற்றும் அழுத்தத்தின் கீழ் உலோகத்துடன் தொடர்பு கொள்ளும்போது, மூலக்கூறு ஹைட்ரஜன் உலோகத்தின் மேற்பரப்பில் பிரிகிறது. இதன் விளைவாக வரும் அணு ஹைட்ரஜன் உலோக லட்டியில் பரவுகிறது மற்றும் அதில் கரைகிறது. குறைந்த கரைதிறன் காரணமாக வெப்பநிலை குறைவதால், ஹைட்ரஜன் உலோகத்தின் உள்ளே ஒரு வாயு நிலைக்கு செல்கிறது. இந்த வழக்கில், உலோகத்தில் பெரிய அழுத்தங்கள் எழுகின்றன, இது மீளமுடியாத உடையக்கூடிய தன்மைக்கு வழிவகுக்கிறது. ஹைட்ரஜன் அரிப்பு என்பது எஃகு கார்பைடு கூறுகளுடன் ஹைட்ரஜனின் வேதியியல் தொடர்புகளின் விளைவாகும். வெளிப்புறமாக, ஹைட்ரஜன் அரிப்பின் வெளிப்பாடு என்பது மேற்பரப்பின் குறிப்பிடத்தக்க அழிவு இல்லாமல் எஃகு வலிமையில் வலுவான குறைவு என்று பொருள். ஹைட்ரஜன் அரிப்பின் பொறிமுறையானது பின்வரும் நிலைகளை உள்ளடக்கியது: - உயர் வெப்பநிலையில், மூலக்கூறு ஹைட்ரஜன் அணுக்களாகப் பிரிகிறது, அவை எஃகு மேற்பரப்பில் உறிஞ்சப்பட்டு அதன் படிக லேட்டிஸில் பரவுகின்றன; − செயலில் குறைக்கும் முகவராக இருப்பதால், அணு ஹைட்ரஜன் இரும்பு கார்பைடைக் குறைக்கிறது மற்றும் எஃகில் கரைந்த கார்பனுடன் மீளமுடியாத எதிர்வினைகள் மூலம் தொடர்பு கொள்கிறது: Fe3C + 2H2 3Fe + CH4 C + 4H CH4, இதனால் எஃகு அதன் வலுப்படுத்தும் தளத்தை இழக்கிறது. ஹைட்ரஜனின் இயக்கம் உட்பட பரவல் செயல்முறைகள், சிமென்டைட் தகடுகள் முக்கியமாக அமைந்துள்ள தானிய எல்லைகளில் மிக எளிதாக உணரப்படுவதால், ஹைட்ரஜனால் அவற்றின் அழிவு படிகங்களுக்கிடையேயான தொடர்பை சீர்குலைத்து, அதன்படி, எஃகு நீர்த்துப்போகும் தன்மையைக் குறைக்கிறது. . 30 ஃபெரைட் கிரிஸ்டல் லேட்டிஸின் அளவுருக்களுடன் ஒப்பிடுகையில், இதன் விளைவாக வரும் மீத்தேன் ஒரு பெரிய மூலக்கூறு அளவைக் கொண்டுள்ளது. இதன் விளைவாக, இது உலோகத்தின் பெரும்பகுதியிலிருந்து பரவ முடியாது மற்றும் அதன் நுண்குழிகள் மற்றும் குறைபாடுகளில் குவிந்து, அதிக உள்குழி அழுத்தம் மற்றும் விரிசல் ஏற்படுகிறது. இந்த வழக்கில், தானிய எல்லைகளில் விரிசல் உருவாகிறது. குறைந்த வலிமை பண்புகளைக் கொண்ட லேசான இரும்புகளில், மீத்தேன் திரட்சிகள் மேற்பரப்பு அடுக்கில் முக்கியமாக நிகழ்கின்றன, எஃகு மேற்பரப்பில் தெளிவாகத் தெரியும் வீக்கங்களை உருவாக்குகின்றன. மீத்தேன் உருவாவதில் பங்கேற்பதோடு கூடுதலாக, ஹைட்ரஜன் உலோகத்தில் நல்ல கரைதிறனைக் கொண்டுள்ளது. உலோகத்தில் கரைந்துள்ள ஹைட்ரஜனின் செறிவு உலோக-வாயு இடைமுகத்தில் ஹைட்ரஜனின் பகுதியளவு அழுத்தத்தைப் பொறுத்தது மற்றும் சூத்திரத்தால் தீர்மானிக்க முடியும்: = Ks p1/2, இதில் என்பது எஃகில் கரைந்த ஹைட்ரஜனின் அளவு, cm3/ 100 கிராம்; p - ஹைட்ரஜனின் பகுதி அழுத்தம், மணிக்கு; Ks - எஃகில் உள்ள ஹைட்ரஜனின் கரைதிறன் p = 1 at. ஒரு உலோகத்தால் ஹைட்ரஜனைக் கரைப்பது ஒரு எண்டோடெர்மிக் செயல்முறை என்பதால், அதிகரிக்கும் வெப்பநிலையுடன் ஹைட்ரஜனின் கரைதிறன் அதிகரிக்கிறது. இந்த நிகழ்வு ஹைட்ரஜன் ஊடுருவல் (VH) 4] என்று அழைக்கப்படுகிறது. எஃகின் ஹைட்ரஜன் ஊடுருவல் கார்பன் மற்றும் கலப்பு கூறுகளின் உள்ளடக்கத்தைப் பொறுத்தது மற்றும் கார்பன் உள்ளடக்கத்தை அதிகரிப்பதன் மூலம் குறைகிறது, இது அட்டவணையில் கொடுக்கப்பட்ட தரவுகளால் நிரூபிக்கப்பட்டுள்ளது. 3. அட்டவணை 3 கார்பன் ஸ்டீல்களின் ஹைட்ரஜன் ஊடுருவலின் மீது கார்பன் உள்ளடக்கத்தின் விளைவு உலோகம் C, wt.% VН, cm3/cm2h mm–1 தொழில்நுட்ப இரும்பு 0.04 5.10 எஃகு 15 0.15 4.09 ஸ்டீல் 30 0.27 2.79 2.79 ஸ்டீல் 4. ஹைட்ரோஜன் U102 எஃகு ஹைட்ரஜனுக்கு வெளிப்படும் தருணத்திலிருந்து உடனடியாக, ஆனால் ஒரு குறிப்பிட்ட காலத்திற்கு பிறகு. இந்த நேரத்தில், எஃகு நுண் கட்டமைப்பு மற்றும் இயந்திர பண்புகளில் எந்த மாற்றமும் இல்லை, இது ஸ்டீல் டிகார்பரிங் செயல்முறையின் அடைகாக்கும் காலம் என்று அழைக்கப்படுகிறது. 31 அடைகாக்கும் காலம் மிகவும் நடைமுறை முக்கியத்துவம் வாய்ந்தது, ஏனெனில் இது கருவிகளின் பாதுகாப்பான இயக்க நேரத்தை அடிப்படையில் தீர்மானிக்கிறது. அடைகாக்கும் காலம் முக்கியமாக வெப்பநிலை மற்றும் அழுத்தத்தைப் பொறுத்தது. அதிகரிக்கும் வெப்பநிலை மற்றும் அழுத்தத்துடன், அடைகாக்கும் காலம் குறைகிறது. அதே நேரத்தில், அடைகாக்கும் காலத்தின் காலம் எஃகு இரசாயன கலவையால் பெரிதும் பாதிக்கப்படுகிறது. ஹைட்ரஜனின் வெப்பநிலை மற்றும் பகுதி அழுத்தம் அடைகாக்கும் காலத்தின் காலத்தை மட்டுமல்ல, ஹைட்ரஜன் அரிப்பின் போது எஃகு டிகார்பரைசேஷன் விகிதத்தையும் பாதிக்கிறது. 2.5.5 கார்போனைல் அரிப்பு உயர் அழுத்தங்கள் மற்றும் வெப்பநிலையில் கார்பனை உள்ளடக்கிய தொழில்நுட்ப செயல்முறைகளில் கார்போனைல் அரிப்பு ஏற்படுகிறது. இத்தகைய செயல்முறைகளில், எடுத்துக்காட்டாக, மெத்தில் மற்றும் பியூட்டில் ஆல்கஹால்களின் உற்பத்தி, மீத்தேன் மற்றும் கார்பன் மோனாக்சைடை மாற்றுதல் ஆகியவை அடங்கும். சாதாரண நிலைமைகளின் கீழ், CO உலோகங்களை நோக்கி மந்தமானது. அதிக வெப்பநிலை மற்றும் அழுத்தங்களில், கார்பன் மோனாக்சைடு பல உலோகங்களுடன் வினைபுரிந்து கார்போனைல்களை உருவாக்குகிறது. உதாரணமாக Fe + nCO = Fe(CO)n. இரும்பு மற்றும் CO மூன்று சேர்மங்களை உருவாக்கலாம்: டெட்ராகார்போனில் - Fe(CO)4, பென்டகார்போனில் - Fe(CO)5 மற்றும் நானோகார்போனில் - Fe(CO)g. இந்த கலவைகள் அனைத்தும் மிகவும் நிலையற்றவை மற்றும் வெப்பநிலை உயரும் போது சிதைந்துவிடும். அவற்றில் மிகவும் நிலையான கலவை Fe(CO)5 ஆகும். கார்போனைல்களின் உருவாக்கம் 100 ºС இலிருந்து அதிகரிக்கும் வெப்பநிலையுடன் அதிகரிக்கிறது, பின்னர், வெப்பநிலை வரம்பில் 140 - 180 ºС, Fe மற்றும் CO ஆக அவற்றின் முழுமையான விலகல் காணப்படுகிறது. கார்பன் மோனாக்சைடு (II) பல உலோகங்களுடன் ஒத்த சேர்மங்களை உருவாக்கலாம். கார்போனைல் அரிப்பு உலோகத்தின் மேற்பரப்பு அடுக்கை 5 மிமீ ஆழத்திற்கு அழித்து தளர்த்துகிறது. மேற்பரப்பில் இருந்து அதிக தொலைவில் உள்ள உலோகத்தின் கட்டமைப்பில் மாற்றங்கள் இனி ஏற்படாது. 2.5.6. எலக்ட்ரோலைட்டுகள் அல்லாத அரிப்பு மின்சாரத்தை கடத்தாத திரவங்கள் அல்லாத எலக்ட்ரோலைட்டுகள். கனிம தோற்றத்தின் திரவ அரிக்கும் ஊடகம் - திரவ புரோமின், உருகிய கந்தகம், முதலியன. திரவ கரிம பொருட்கள் - பென்சீன், குளோரோஃபார்ம், முதலியன, திரவ எரிபொருள் (எண்ணெய், மண்ணெண்ணெய், பெட்ரோல், முதலியன), மசகு எண்ணெய்கள். அவற்றின் தூய வடிவத்தில், அவை குறைந்த ஆக்கிரமிப்பு கொண்டவை, இருப்பினும், அவற்றில் சிறிய அளவிலான அசுத்தங்கள் (மெர்காப்டன்ஸ் 14, ஹைட்ரஜன் சல்பைட், நீர், ஆக்ஸிஜன் போன்றவை) இருப்பதால் அவற்றின் இரசாயன செயல்பாட்டைக் கூர்மையாக அதிகரிக்கிறது. இவ்வாறு, கச்சா எண்ணெயில் உள்ள மெர்காப்டான்கள் மற்றும் ஹைட்ரஜன் சல்பைடு ஆகியவை முறையே Fe, Cu, Ni, Ag, Pb, Sn ஆகியவற்றின் மெர்காப்டைடுகள் (Me−(S−R)n) மற்றும் பாலிசல்பைடுகள் (Me2Sx) உருவாவதன் மூலம் அரிப்பை ஏற்படுத்துகின்றன. கார்பன் டெட்ராகுளோரைடில் உள்ள நீரின் தடயங்கள் நீராற்பகுப்பின் விளைவாக கடத்தும் கூறுகள் (HCl) உருவாவதாலும், மின்வேதியியல் பொறிமுறையால் அரிப்பு ஏற்படுவதாலும் அதன் அரிப்பை அதிகரிக்கிறது: CCl4 + H2O → COCl2 + 2HCl CCl4 + 2H2O + HCl2 + HCO2 + → முக்கியமாக எலக்ட்ரோலைட்டுகள் அல்லாத உலோகங்களின் அரிப்பு ஒரு வேதியியல் பொறிமுறையின் மூலம் தொடர்கிறது. இந்த செயல்முறை பல நிலைகளைக் கொண்டுள்ளது, ஒவ்வொன்றும் அரிப்பு விகிதத்தை தீர்மானிக்கிறது: 1) உலோக மேற்பரப்பில் ஆக்ஸிஜனேற்றத்தின் பரவல்; 2) ஆக்ஸிஜனேற்ற முகவரின் வேதியியல் உறிஞ்சுதல்; 3) இரசாயன எதிர்வினை; 4) உலோக மேற்பரப்பில் இருந்து அரிப்பு பொருட்கள் desorption; 5) எலக்ட்ரோலைட் அல்லாத அளவிற்கு அரிப்பு தயாரிப்புகளின் பரவல். சில சந்தர்ப்பங்களில், அரிப்பு தயாரிப்புகளிலிருந்து ஒரு உலோக மேற்பரப்பில் ஒரு பாதுகாப்பு படம் உருவாகிறது, இது உலோக மேற்பரப்பில் ஆக்ஸிஜனேற்றத்தின் பரவல் சிரமம் காரணமாக அரிப்பு செயல்முறையைத் தடுக்கிறது. விளைந்த படத்தின் பாதுகாப்பு பண்புகள் மற்றும் அதன் கரைதிறன், பரவல், இயக்கவியல் அல்லது கலப்பு பரவல்-இயக்கக் கட்டுப்பாடு ஆகியவற்றைப் பொறுத்து செயல்முறை நிறுவப்படலாம். எலக்ட்ரோலைட்டுகள் அல்லாத உலோகங்களின் வேதியியல் அரிப்பு விகிதத்தை வெப்பநிலை கணிசமாக பாதிக்கிறது (பிரிவு 2.4 ஐப் பார்க்கவும்). செயல்முறையின் விகிதத்தில் வெப்பநிலையின் விளைவு சில சந்தர்ப்பங்களில் ஆக்ஸிஜனேற்றத்தின் கரைதிறன் மற்றும் வெப்பநிலை மாறும்போது எலக்ட்ரோலைட் அல்லாத உலோக அரிப்பு தயாரிப்புகளின் படம் ஆகியவற்றால் சிக்கலானது. 14 மெர்காப்டன்கள் ஹைட்ரோகார்பன்களின் ஹைட்ரோசல்பைட் வழித்தோன்றல்கள்: R – S –H. 33 அல்லாத எலக்ட்ரோலைட்டுகளில் நீரின் இருப்பு அசுத்தங்களின் அரிக்கும் விளைவை கணிசமாக செயல்படுத்துகிறது மற்றும் உலோகங்களின் தீவிர மின்வேதியியல் அரிப்பை ஏற்படுத்துகிறது, அதாவது. அரிப்பு செயல்முறையின் வழிமுறை மாறுகிறது. ரசாயன அரிப்பிலிருந்து எலக்ட்ரோலைட்டுகள் அல்லாத உலோகங்களைப் பாதுகாக்க, கொடுக்கப்பட்ட சூழலில் நிலையானதாக இருக்கும் உலோகங்கள் மற்றும் உலோகக் கலவைகள் தேர்ந்தெடுக்கப்படுகின்றன (எடுத்துக்காட்டாக, அலுமினியம் மற்றும் அதன் கலவைகள் வெடிப்பு பெட்ரோலில் நிலையானவை), மற்றும் பாதுகாப்பு பூச்சுகள் பயன்படுத்தப்படுகின்றன (எடுத்துக்காட்டாக, எஃகு ஒரு ஹைட்ரஜன் சல்பைட் சூழல் அலுமினியத்துடன் பூசப்பட்டுள்ளது). 2.6 பல்வேறு வகையான வாயு அரிப்புகளிலிருந்து உலோகங்களைப் பாதுகாப்பதற்கான முறைகள் 2.6.1. எரிவாயு அரிப்பிலிருந்து எஃகு பாதுகாக்கும் முறைகள் வாயு அரிப்பிலிருந்து எஃகு பாதுகாக்க, வெப்ப-எதிர்ப்பு அலோயிங் மற்றும் பாதுகாப்பு பூச்சுகள் மிகவும் பரவலாகப் பயன்படுத்தப்படுகின்றன. கலப்பு - (ஜெர்மன் லெஜிரென் - "உருகி", லத்தீன் லிகரே - "பிணைக்க") - அடிப்படைப் பொருளின் இயற்பியல் மற்றும்/அல்லது வேதியியல் பண்புகளை மாற்ற (மேம்படுத்த) பொருட்களின் கலவையில் அசுத்தங்களைச் சேர்த்தல். அதிக வெப்பநிலையில் ஆக்சிஜனேற்றத்திலிருந்து உலோகங்களைப் பாதுகாப்பதற்கான முக்கிய முறைகள் ALLOYING ஐ அடிப்படையாகக் கொண்டவை. அதிக வெப்பநிலையில் ஆக்ஸிஜனேற்றப்பட்ட உலோகங்களின் எதிர்ப்பானது உலோகத்தை உள்ளடக்கிய ஆக்சைடு படத்தின் பாதுகாப்பு பண்புகளை சார்ந்துள்ளது. இரும்பு-கார்பன் கலவைகளில் ஒரு பாதுகாப்பு அடுக்கு உருவாக்க பங்களிக்கும் கூறுகள் குரோமியம், அலுமினியம் மற்றும் சிலிக்கான் ஆகும். இந்த தனிமங்கள் உலோகக் கலவையை விட காற்றில் அதிக வெப்பநிலையில் எளிதாக ஆக்சிஜனேற்றம் செய்து மேலும் நிலையான அளவை உருவாக்குகின்றன. வெப்ப-எதிர்ப்பு கலவையின் கோட்பாட்டின் படி, உலோகக் கலவையின் கூறு ஆக்சைடு மட்டுமே கொண்ட உலோக மேற்பரப்பில் ஒரு பாதுகாப்பு அடுக்கை உருவாக்குகிறது. கலவை உறுப்பு பின்வரும் அடிப்படை தேவைகளை பூர்த்தி செய்ய வேண்டும்: உலோகத்தின் மேற்பரப்பில் உருவாகும் ஆக்சைடு தொடர்ச்சியாக இருக்க வேண்டும், அதாவது. Vok/VMe விகிதம் >1 ஆக இருக்க வேண்டும். ஆக்சைடு அடுக்கு உயர் ஓமிக் எதிர்ப்பைக் கொண்டிருக்க வேண்டும் rMeO > rFe, கலப்பு கூறு அயனிகளின் அளவு அடிப்படை உலோக அயனிகளின் அளவை விட சிறியதாக இருக்க வேண்டும், அதாவது. rMe< rFe. Это условие вытекает из следующих соображений: 34 а) меньший радиус иона легирующего компонента по сравнению с ионом основного металла позволяет предполагать у легирующего компонента больший коэффициент диффузии в сплаве, что может обеспечить преимущественный выход ионов компонента на поверхность сплава и, следовательно, преимущественное образование оксида легирующего компонента; б) меньший радиус иона легирующего компонента позволит образовать оксид с соответствующими меньшими параметрами, который будет оказывать большое сопротивление диффузии через него и, следовательно, создавать большое затруднение для окисления основного металла. Это подтверждается сравнением размеров ионных радиусов железа и легирующих элементов: хрома, алюминия и кремния Ион металла Ионный радиус, Аº Fe2+ 0,74 Cr6+ 0,52 Al3+ 0,50 Si4+ 0,41. А энергия образования оксида легирующего компонента должна быть больше энергии образования оксида основного металла ΔGMeO<ΔGFeO. Если это условие не соблюдается, то оксид легирующего компонента будет восстанавливаться основным компонентом, как например, оксидная пленка меди, которая не может быть устойчивой на железном сплаве вследствие возможности протекания реакции CuO+Fe → FeO+Cu. При этом необходимо соблюдение условий: высокая температура плавления оксида легирующего компонента, низкая упругость диссоциации, а также отсутствие низкоплавких эвтектик в смеси с другими оксидами для того, чтобы оксид легирующего компонента был достаточно устойчив. В качестве примера можно привести элемент бор, который является аналогом Al по таблице Менделеева, но дает легкоплавкие оксиды. Температура плавления ВО3 − 294 0С, и поэтому бор, в отличие от алюминия, не может быть легирующим компонентом, повышающим жаростойкость. Необходимым условием является также, образование твердых растворов между легирующими компонентами и основным металлом, так как при этом условии возможно равномерное распределение этого элемента на поверхности и образование сплошной пленки оксида легирующего компонента. 35 Существует и другая теория, согласно которой легирующий элемент образует на поверхности сплава смешанные оксиды, обладающие повышенными защитными свойствами, по сравнению с оксидами чистых компонентов. Механизм повышения жаростойкости можно свести к тому, что легирующий компонент должен уменьшить возможность образования в окалине вюститной фазы (FeO) на стали и, таким образом, благоприятствовать образованию шпинельной фазы типа Fe3O4ּγFe2O3 с возможно меньшим параметром решетки. Жаростойкие легированные стали имеют на поверхности оксидные слои со структурой именно шпинели. Еще более высокими защитными свойствами обладают сложные шпинели типа FeOּMe2O3 или Fe2O3 ּMeO. С целью экономии легированных сталей жаростойкость углеродистых сталей повышают, применяя защитные покрытия. Для нанесения на сталь защитных покрытий пользуются следующими методами: ТЕРМОДИФФУЗИОННЫМ, НАПЛАВКОЙ И ПЛАКИРОВАНИЕМ. Для нанесения покрытий термодиффузионным методом стальное изделие после очистки поверхности механическим способом и травлением помещают в реакционную смесь, состоящую из порошка наносимого металла и катализатора. Например, при нанесении алюминиевых покрытий смесь содержит измельченный ферроалюминиевый и хлористый аммоний. Процесс насыщения поверхности стали алюминием (АЛИТИРОВАНИЕ) производится при высоких температурах (900−9500С), в результате чего происходит разложение хлористого аммония на аммиак и хлористый водород: NH4Cl → NH3 + HCl, который, в свою очередь, взаимодействует с алюминием 2Al +6HCl → 3H2 + 2AlCl3. На поверхности стального изделия происходит выделение атомарного алюминия AlCl3 +Fe → FeCl3 + Al, который диффундирует в сталь. Значительное повышение жаростойкости стали термодиффузионным покрытием обусловлено образованием окислов Al2O3 или двойных окислов FeAl2O4 в алитированном слое. На поверхности хромированных или силицированных изделий образуются соответствующие оксиды хрома или кремния. 36 НАПЛАВКА − это нанесение слоя металла или сплава на поверх- ность изделия посредством сварки плавлением. ПЛАКИРОВА́НИЕ − (фр. plaquer − накладывать, покрывать) термомеханическое покрытие − нанесение на поверхность металлических листов, плит, проволоки, труб тонкого слоя другого металла или сплава термомеханическим способом. Для защиты от карбонильной коррозии применяют хромистые стали с содержанием 30 % Сг, хромоникелевые стали с содержанием 23 % Сг и 20 % № и марганцевые бронзы доя работы при температуре до 700 °С и давлении до 35 МПа. При более низких параметрах возможно применение менее легированных сталей типа Х18Н9. Сырьем для синтеза мочевины CO(NH2)2 является NH3 и СО2. Процесс протекает при температуре 175−190°С и давлении 20 МПа. Хромистые нержавеющие стали различных марок непригодны для изготовления основных аппаратов. Наибольшую стойкость имеют стали, легированные молибденом, и хромникельмолибденовомедные стали. Важным фактором для повышения коррозионной устойчивости является тщательная очистка газов от сероводорода и дополнительное введение в систему кислорода в количестве 0,5- 1,0 об.% от содержания СО2. При сернистой коррозии сера и ее соединения - сернистый ангидрид (SO2), сероводород (H2S), меркаптаны или тиоспирты и т.д. являются достаточно агрессивными, коррозионно−активными веществами. Наиболее активным компонентом при высокотемпературной газовой коррозии является сероводород. Он даже более опасен, чем диоксид серы. Сернистый газ SO2 является исходным продуктом при производстве серной кислоты. Его получают при обжиге серного колчедана, сжигании серы, из сероводорода при утилизации отходящих газов металлургических производств. Чугунные детали скребков конверторных печей кипящего слоя, зубья и гребки колчеданных печей, котлы−утилизаторы, сухие электрофильтры, газоходы обжиговых газов в производстве серной кислоты часто выходят из строя вследствие газовой коррозии. В результате коррозии черных металлов в сернистом газе при температурах 300°С и выше образуется слоистая окалина, состоящая из FeS, FeO и др. 37 При температуре газа более 400 °С для деталей из чугуна характерно увеличение объема металла, достигающего 10 % от начальной величины. При этом резко снижается прочность материала. Детали испытывают коробление, трескаются и разрушаются. Это явление называется «ростом» чугуна и объясняется внутренним окислением металла. Максимальный рост чугуна наблюдается при 700 °С. К ростоустойчивым чугунам относятся высоколегированные хромистые чугуны, карбидный чугун типа «пирофераль» и «чугаль» Сернистый газ при высоких температурах окисляет никель. При этом образуется окалина, в состав которой входят NiS и NiO: 3Ni + S02 = NiS + 2NiO. Сернистый никель образуется и при действии на металл сероводорода: Ni + H2S = NiS + Н2. Сульфид никеля с металлическим никелем образует легкоплавкую эвтектику с температурой плавления около 625 °С. Образование этой эвтектики в сталях, содержащих никель, происходит преимущественно по границам зерен, вызывая разрушение металла. Стали с содержанием никеля выше 15 % очень чувствительны к действию сернистого газа. В процессе окисления они теряют механическую прочность. Поэтому при работе с газовой средой, содержащей диоксид серы, при температурах до 400 °С используют углеродистые стали, а при более высоких температурах − хромистые стали. Наиболее употребительны жаростойкие стали − 4Х9СА, Х6СЮ, XI7, ОХ 17 Г, X1800, Х25Т. Интенсивное образование окалины происходит при температурах выше 800−1000 °С. К жаропрочным сталям в этой среде относятся Х5М, Х6СМ, XI8Н12Т, Х23Н18. Рабочая температура для этих сплавов 550−600 °С (для Х23Н18 − 1000 °С). Сухой сернистый газ реагирует с алюминием очень медленно. Поэтому алюминий используют для защиты от коррозии деталей и узлов теплообменников и контактных аппаратов. Сухой сероводород при комнатной температуре не представляет опасности для обычных углеродистых сталей. С повышением температуры опасность сероводородной коррозии углеродистых сталей значительно увеличивается. При температуре выше 300 °С 38 железо подвергается сильной коррозии в серосодержащих газовых средах. Легирование хромом в количестве > 700−800 °C வரை வெப்பநிலையில் 12% அரிப்பு எதிர்ப்பை அதிகரிக்கிறது. குரோமியம் இரும்புகள் அரிக்கும் போது, அளவு உருவாகிறது, அதன் வெளிப்புற அடுக்கு இரும்பு சல்பைடு கொண்டது. இந்த அடுக்கில் நடைமுறையில் குரோமியம் இல்லை. அனைத்து ஆக்ஸிஜனேற்றப்பட்ட குரோமியம் உள் அடுக்கில் குவிந்துள்ளது, இது ஒரு பாதுகாப்பு சொத்து உள்ளது. ஃபெரிடிக் படம் 5 10 15 20 சல்பர்-Cr, wt.% ஹைட்ரஜனின் வளிமண்டலத்தில் நல்ல இரசாயன எதிர்ப்பைக் கொண்டுள்ளது. 6. 650 °C இல் எண்ணெய் நீராவியில் 25-30% திட எஃகு கொண்டிருக்கும் குரோமியம் உலோகக் கலவைகளின் அரிப்பு விகிதம். வளைவுகளில் உள்ள எண்கள் குரோமியத்தைக் குறிக்கின்றன. H2S உள்ளடக்கம், % குறிப்பாக ஆபத்தானது சல்பர் கலவைகள் மற்றும் பிற அரிக்கும் கூறுகளின் ஒருங்கிணைந்த இருப்பு. இவ்வாறு, எண்ணெய் துறையில், கந்தக எண்ணெய்களின் வெப்ப செயலாக்கத்தின் போது, ஹைட்ரஜன் சல்பைடு மற்றும் ஹைட்ரஜன் கலவையானது ஒரு குறிப்பிட்ட ஆபத்தை ஏற்படுத்துகிறது. படத்தில் காட்டப்பட்டுள்ளவற்றிலிருந்து. எண்ணெய் நீராவியில் ஹைட்ரஜன் சல்பைட்டின் செறிவு அதிகரிப்பதால் குரோமியம் ஸ்டீல்களின் அரிப்பு விகிதம் அதிகரிக்கிறது என்பதை 6 தரவு காட்டுகிறது. இந்த வழக்கில், H2S செறிவு 10 மடங்கு அதிகரிப்பது அரிப்பு விகிதத்தில் 12-15 மடங்குக்கு மேல் அதிகரிக்கிறது. எரிபொருள் எரியும் போது, O2 மற்றும் பல்வேறு ஆக்சைடுகளைக் கொண்ட சிக்கலான வாயு கலவைகள் உருவாகின்றன, இதில் கந்தக அசுத்தங்கள் அடங்கும். இந்த சந்தர்ப்பங்களில், சல்ஃபைட்-ஆக்சைடு அரிப்பு காணப்படுகிறது. உலோகத்தில் பாதுகாப்பு படம் பொதுவாக பல அடுக்குகளைக் கொண்டுள்ளது. வெளிப்புற அடுக்கு ஆக்ஸிஜனுடன் செறிவூட்டப்பட்டுள்ளது மற்றும் உலோக ஆக்சைடு கொண்டது, மேலும் உலோக மேற்பரப்புக்கு அருகில் உள்ள உள் அடுக்குகளில் கந்தகம் மற்றும் சல்பைடுகள் அதிகரித்த அளவு உள்ளது. எரிபொருளின் எரிப்பு சாம்பலை உருவாக்கினால், அதில் வெனடியம் ஆக்சைடு V2O5 உள்ளது, பின்னர் அரிப்பு விகிதம் மிக விரைவாக அதிகரிக்கிறது. இரும்புகளின் வெனடியம் அரிப்புக்கான காரணங்கள் முன்னர் விவாதிக்கப்பட்டன (பிரிவு 2.5.2 ஐப் பார்க்கவும்). 39 4−6% Cr கொண்ட குரோமியம் இரும்புகள் அரை-வெப்ப-எதிர்ப்பு என்று கருதப்படுகிறது. இந்த வகுப்பின் இரும்புகள், அவற்றின் கிடைக்கும் தன்மை, அதிகரித்த அரிப்பு எதிர்ப்பு மற்றும் வலிமை ஆகியவற்றின் காரணமாக, விரிசல் அலகுகள் தயாரிப்பதற்கு எண்ணெய் துறையில் பரவலாகப் பயன்படுத்தப்படுகின்றன. 500−600 ºС வெப்பநிலையில் கந்தக சேர்மங்களின் குறிப்பிடத்தக்க உள்ளடக்கத்துடன் காற்று மற்றும் ஃப்ளூ வாயுக்களில் இந்த இரும்புகளின் வெப்ப எதிர்ப்பானது கலக்கப்படாத இரும்புகளின் வெப்ப எதிர்ப்பை விட சுமார் 3 மடங்கு அதிகமாகும். 2.6.2. ஹைட்ரஜன் அரிப்புக்கு எதிரான பாதுகாப்பு முறைகள் இரும்புகளின் ஹைட்ரஜன் எதிர்ப்பை அதிகரிப்பதற்கான முக்கிய வழிகளில் ஒன்று, சிமென்டைட்டை விட நிலையான கார்பைடுகளை உருவாக்கும் வலுவான கார்பைடு-உருவாக்கும் கூறுகளுடன் அவற்றை அலாய் செய்வதாகும். இத்தகைய கூறுகள் குரோமியம், டங்ஸ்டன், மாலிப்டினம், வெனடியம், நியோபியம், டைட்டானியம். கார்பைடு கட்டத்தின் வகை எஃகு ஹைட்ரஜன் எதிர்ப்பில் பெரும் தாக்கத்தை ஏற்படுத்துகிறது. குரோமியத்துடன் கலந்த இரும்புகளில், பின்வரும் தொடரில் கார்பைடு கட்டத்தின் கலவையைப் பொறுத்து ஹைட்ரஜன் எதிர்ப்பு குறைகிறது: (Cr,Fe)23C6(Cr,Fe)23C6 + (Cr,Fe)7C3(Cr,Fe) 7C3 (Cr,Fe)7C3 + (Fe,Cr)3C(Fe,Cr)3C (Cr,Fe) கார்பைடுகளை உருவாக்குவதன் மூலம் குரோமியம் இரும்புகளில் மிகப்பெரிய ஹைட்ரஜன் எதிர்ப்பு அடையப்படுகிறது என்பதை மேலே உள்ள தொடர் காட்டுகிறது. )23C6 வகை. எஃகில் 0.05% கார்பன் உள்ளடக்கத்துடன் இந்த வகை கார்பைடு உருவாக்கம் எஃகில் குறைந்தது 6% குரோமியம் இருக்கும்போது ஏற்படுகிறது, மேலும் கார்பன் உள்ளடக்கத்தின் அதிகரிப்புடன், குரோமியம் உள்ளடக்கத்தில் அதிகரிப்பு அவசியம். குரோமியத்தை விட வலுவான கார்பைடு-உருவாக்கும் தனிமங்களுடன் எஃகு கலப்பு செய்யும் போது, இந்த தனிமங்கள் அனைத்து கார்பனையும் MeC-வகை கார்பைடுகளுடன் பிணைக்க போதுமான அளவுகளில் இருக்கும்போது எஃகின் மிகப்பெரிய ஹைட்ரஜன் எதிர்ப்பு அடையப்படுகிறது. அதிக அளவிலான இயந்திர சுமைகளின் நிலைமைகளின் கீழ் உபகரணங்கள் கூறுகள் செயல்படும் சந்தர்ப்பங்களில், ஹைட்ரஜன்-எதிர்ப்பு இரும்புகள் வெப்ப எதிர்ப்பையும் கொண்டிருக்க வேண்டும். இந்த நிலைமைகளுக்கு, 3% Cr கொண்ட இரும்புகள், கூடுதலாக Mo, V அல்லது W ஆகியவற்றுடன் கலக்கப்படுகின்றன, எடுத்துக்காட்டாக எஃகு தரம் 20Х3МВФ (EI579). எஃகு தரங்கள் X5M, X5VF, X9M, 1X13 இன்னும் அதிக எதிர்ப்பைக் கொண்டுள்ளன. மிகவும் கடுமையான நிலைகளில், ஆஸ்டெனிடிக் வெப்ப-எதிர்ப்பு குரோமியம்-நிக்கல் இரும்புகள் 0Х18Н10Т அல்லது Х17Н17М2Т பயன்படுத்தப்படுகின்றன. 40 எஃகுகளின் ஹைட்ரஜன் எதிர்ப்பை அதிகரிப்பதற்கான மற்றொரு பரவலாகப் பயன்படுத்தப்படும் முறை, அடிப்படை உலோகத்தை விட குறைவான ஹைட்ரஜன் ஊடுருவலைக் கொண்ட உலோகங்களால் அவற்றை மூடுவதாகும். இது அடிப்படை உலோகம் மற்றும் உறைப்பூச்சு அடுக்குக்கு இடையே உள்ள இடைமுகத்தில் ஹைட்ரஜனின் செறிவைக் குறைக்கிறது மற்றும் அடிப்படை உலோகத்தில் அதன் ஆக்கிரமிப்பு விளைவைக் குறைக்கிறது. அடிப்படை-பூச்சு உலோக இடைமுகத்தில் பயனுள்ள ஹைட்ரஜன் அழுத்தத்தின் கணக்கீடு சமன்பாட்டின் படி மேற்கொள்ளப்படுகிறது: 1/2 1/2 p2 = p1 (11) + இங்கு p1 என்பது வெளிப்புற மேற்பரப்பில் உள்ள ஹைட்ரஜன் அழுத்தமாகும். உறைப்பூச்சு அடுக்கு; p2 என்பது பூச்சு-அடிப்படை உலோக இடைமுகத்தில் பயனுள்ள ஹைட்ரஜன் அழுத்தம்; = VН1/VН2 என்பது உறைப்பூச்சு அடுக்கு மற்றும் அடிப்படை உலோகத்தின் ஹைட்ரஜன் ஊடுருவலின் விகிதமாகும்; = l1/l2 - முறையே உறைப்பூச்சு அடுக்கு மற்றும் அடிப்படை உலோகத்தின் தடிமன் விகிதம். ஹைட்ரஜன் ஊடுருவலை அதிகரிக்கும் பொருட்டு, உலோகங்கள் மற்றும் உலோகக்கலவைகளை ஒரு வரிசையில் அமைக்கலாம்: அலுமினியம், தாமிரம், நிக்கல், X18N10T, 0X13. நடைமுறையில், இரசாயன மற்றும் எண்ணெய் சுத்திகரிப்பு தொழில்கள் முக்கியமாக 0Х13 அல்லது Х18Н10Т இரும்புகளின் பாதுகாப்பு அடுக்குடன் கார்பன் அல்லது குறைந்த-அலாய் ஸ்டீல்களால் செய்யப்பட்ட பைமெட்டல்களைப் பயன்படுத்துகின்றன. தேர்ந்தெடுக்கப்பட்ட எஃகில் இருந்து தயாரிக்கப்படும் உபகரணங்களின் இயக்க வெப்பநிலை ஹைட்ரஜன் அரிப்பு சாத்தியம் உள்ளதை விட 25 டிகிரி செல்சியஸ் குறைவாக பராமரிக்கப்பட வேண்டும். அத்தியாயம் 3. உலோகங்களின் மின் வேதியியல் அரிப்பு 3.1. உலோகங்களின் மின்முனை ஆற்றல்கள் ஒரு உலோகம் எலக்ட்ரோலைட்டில் மூழ்கும்போது, இரட்டை மின் அடுக்கு 5, 6 உருவாவதன் காரணமாக கட்ட எல்லையில் ஒரு சாத்தியமான ஜம்ப் ஏற்படுகிறது. ஒரு உலோகத் தகடு, எடுத்துக்காட்டாக, ஒரு செப்புத் தகடு, தண்ணீரில் அல்லது செப்பு உப்புக் கரைசலில் மூழ்கியிருந்தால், நேர்மறையாக சார்ஜ் செய்யப்பட்ட Cu2+ அயனிகள் தண்ணீருடன் எல்லையில் அமைந்துள்ள உலோக அடுக்கிலிருந்து தண்ணீருக்குள் செல்லத் தொடங்கும். இந்த வழக்கில், அதிகப்படியான எலக்ட்ரான்கள் உலோகத்தின் படிக லட்டியில் தோன்றும், மேலும் தட்டு எதிர்மறை கட்டணத்தைப் பெறுகிறது. எதிர்மறையாக சார்ஜ் செய்யப்பட்ட தட்டு மற்றும் தீர்வுக்குள் சென்ற நேர்மறை அயனிகளுக்கு இடையே ஒரு மின்னியல் ஈர்ப்பு எழுகிறது, இது செப்பு அயனிகளை கரைசலில் மேலும் மாற்றுவதைத் தடுக்கிறது, அதாவது உலோகத்தை கரைக்கும் செயல்முறை நிறுத்தப்படும். அதே நேரத்தில், எதிர் செயல்முறை உருவாகிறது: கரைசலில் இருந்து செப்பு அயனிகள், தட்டின் மேற்பரப்பை நெருங்கி, அதிலிருந்து எலக்ட்ரான்களை ஏற்றுக்கொண்டு நடுநிலை நிலைக்கு செல்கின்றன. ஒரு குறிப்பிட்ட காலத்திற்குப் பிறகு, டைனமிக் சமநிலையின் நிலை நிறுவப்பட்டது, இதில் உலோகத்திலிருந்து அயனிகளை கரைசலுக்கு மாற்றும் விகிதம் கரைசலில் இருந்து உலோகத்தின் மீது அயனிகளை வெளியேற்றும் விகிதத்திற்கு சமம். விவரிக்கப்பட்ட நிகழ்வு படத்தில் திட்டவட்டமாக காட்டப்பட்டுள்ளது. 7 (உலோக அயனிகள் எளிமைக்காக நீரற்றதாகக் காட்டப்படுகின்றன). பரிசீலனையில் உள்ள உதாரணத்திற்கான கரைசலில் உள்ள அயனிகளுக்கும் உலோகத்திற்கும் இடையிலான சமநிலை சமன்பாட்டின் மூலம் வெளிப்படுத்தப்படுகிறது: Cu2+р−р + 2ē Cuºcrystal ஒரு மின்வேதியியல் எதிர்வினையின் சமநிலை சமன்பாட்டில், எலக்ட்ரான்கள் பொதுவாக இடது பக்கத்தில் எழுதப்படுகின்றன. அதாவது, குறைப்பு செயல்முறை எழுதப்பட்டுள்ளது. படம்.7. உலோக-தீர்வு இடைமுகத்தில் ஒரு இரட்டை மின்சார அடுக்கு தோற்றமளிக்கும் திட்டம், மேலே உள்ள எடுத்துக்காட்டில் இருந்து பார்க்க முடியும், ஒரு உலோகம் அதன் உப்பு கரைசலுடன் தொடர்பு கொள்ளும்போது, இரண்டு தொடர்பு கட்டங்கள் எதிர் கட்டணங்களைப் பெறுகின்றன. இதன் விளைவாக, கட்ட இடைமுகத்தில் இரட்டை மின்சார அடுக்கு உருவாகிறது மற்றும் உலோகத்திற்கும் தீர்வுக்கும் இடையில் ஒரு சாத்தியமான ஜம்ப் () ஏற்படுகிறது. வெவ்வேறு உலோகங்களின் இரண்டு உலோகத் தகடுகள் (M1 மற்றும் M11) கரைசலில் குறைக்கப்பட்டால், ஒரு கால்வனிக் ஜோடி எழும், இதில் குறைந்த செயலில் உள்ள உலோகம் குறைக்கப்படும் மற்றும் அதிக செயலில் உள்ள உலோகம் ஆக்ஸிஜனேற்றப்படும் (படம் 8). அரிசி. 8. ஒரு கால்வனிக் கலத்தின் செயல்பாட்டின் திட்டம் பொதுவாக, இந்த கால்வனிக் ஜோடியின் வேலை சாத்தியமான வேறுபாடு (கால்வனிக் கலத்தின் emf) மூலம் தீர்மானிக்கப்படுகிறது மற்றும் அரை-எதிர்வினைகளின் சமநிலையுடன் உள்ளது: E = ox - red, இதில் ox என்பது ஆக்ஸிஜனேற்றியின் திறன், V; ரெட் - குறைக்கும் முகவர் சாத்தியம், V. Men+(ox) + ne ⇆ MEº Meº(red) − ne ⇄ MEn+. ஒரு யூனிட் நேரத்திற்கு கரைசலில் செல்லும் கேஷன்களின் எண்ணிக்கை உலோக மேற்பரப்பில் டெபாசிட் செய்யப்பட்ட கேஷன்களின் எண்ணிக்கைக்கு சமமாக மாறும் போது, டைனமிக் சமநிலை ஏற்படும் மற்றும் கரைக்கும் செயல்முறை நிறுத்தப்படும். எனவே, இத்தகைய நிலைமைகளின் கீழ் அதிக எண்ணிக்கையிலான உலோக அயனி அணுக்களை கரைசலாக மாற்றுவது சாத்தியமற்றது. இருப்பினும், எலக்ட்ரான்களை வெளியேற்றுவதன் மூலமோ அல்லது உலோக அயனி அணுக்களை அகற்றுவதன் மூலமோ மின் இரட்டை அடுக்கின் சமநிலை சீர்குலைந்தால், அரிப்பு செயல்முறை தடையின்றி தொடரும். அவற்றின் சொந்த அயனிகளுடன் சமநிலையில் இருக்கும் உலோகங்களின் மின்முனை ஆற்றல்கள் சமநிலை என்று அழைக்கப்படுகின்றன. Nernst சமன்பாட்டைப் பயன்படுத்தி எந்த அயனிச் செயல்பாட்டிற்கும் சமநிலை சாத்தியத்தின் மதிப்பைக் கணக்கிடலாம்: E = Eº + (RT /nF)ln(aMen+), (12) n+ இங்கு Eº என்பது aMe = 1 இல் நிலையான சாத்தியமான வேறுபாடு; ஆர் - உலகளாவிய வாயு மாறிலி, 8.3 kJ/kmolK; டி - முழுமையான வெப்பநிலை, ºK; n - உலோக வேலன்ஸ்; F - ஃபாரடே எண் 96500 C/mol; 43 aMen+ - mol/l இல் உலோக அயனிகளின் செயல்பாடு. 25°C (T = 298 K) இல் அனைத்து மாறிலிகளையும் மாற்றி, இயற்கை மடக்கைகளிலிருந்து தசமங்களுக்குச் செல்ல 2.3 ஆல் பெருக்கினால், பின்வரும் வெளிப்பாடு E = Eº + (0.0592/n)log(aMen+), ( 13) தீர்வு நீர்த்தப்படும் போது, உலோகத்தின் சாத்தியம் எதிர்மறை பக்கத்திற்கு மாறுகிறது. எடுத்துக்காட்டாக, துத்தநாக உப்பின் கரைசலில் Zn2+ அயனிகளின் செயல்பாடு 10-2 mol/l ஆக இருந்தால், இந்தக் கரைசலில் மூழ்கியிருக்கும் துத்தநாகத்தின் சமநிலைத் திறன் இதற்கு சமமாக இருக்கும்: E = - 0.76 + (0.0592/2) lg10−2 = - 0.819 V, (14) கரைசலில் உலோக அயனிகளின் செறிவு அதிகரிப்புடன், உலோகத் திறன், மாறாக, நேர்மறை திசையில் மாறுகிறது. இவ்வாறு, துத்தநாக அயனிகளின் செயல்பாடு 10 mol/l ஆக எடுத்துக் கொள்ளப்பட்டால், துத்தநாகத்தின் ஆற்றல் E = - 0.76 + (0.0592/2)log10 = - 0.73 V, (15) உலோகங்களின் மின்முனை ஆற்றல்கள். சாத்தியத்தை தீர்மானிக்கும் பரிமாற்ற செயல்முறையானது அதன் சொந்தம் மட்டுமல்ல, மற்ற அயனிகள் மற்றும் அணுக்களையும் உள்ளடக்கியது, அவை சமநிலையற்ற அல்லது மீள முடியாதவை என்று அழைக்கப்படுகின்றன. சமநிலையற்ற சாத்தியக்கூறுகளுக்கு, நெர்ன்ஸ்ட் சூத்திரம் பொருந்தாது, ஏனெனில் உலோகத்தில் ஏற்படும் எதிர்வினைகள், அதாவது. எலக்ட்ரான்களின் இழப்பு மற்றும் கையகப்படுத்தல் வெவ்வேறு வழிகளில் நிகழ்கிறது, மேலும் மின்முனையில் ஏதேனும் ஒரு எதிர்வினையின் சமநிலையின் தொடக்கத்தை சாத்தியம் வகைப்படுத்த முடியாது. எலக்ட்ரோலைட்டின் தன்மை, வெப்பநிலை, எலக்ட்ரோலைட்டின் இயக்கம், கரைசல் செறிவு போன்றவற்றால் சமநிலையற்ற ஆற்றல்களின் அளவு பாதிக்கப்படுகிறது. எடுத்துக்காட்டாக, 3% NaCl இல் அலுமினியத்தின் சாத்தியம் − 0.6 V, 0.05 M Na2SO4 - 0.47 V, மற்றும் 0.05 M Na2SO4 + H2S - 0.23 V. உலோகம் அல்லது எலக்ட்ரோலைட்டின் மேற்பரப்பின் மின் வேதியியல் பன்முகத்தன்மை காரணமாக, உலோகத்தின் மீது பல்வேறு ஆற்றல்கள் கொண்ட பகுதிகள் உருவாகின்றன. உலோக மேற்பரப்பின் மின் வேதியியல் பன்முகத்தன்மையை ஏற்படுத்தும் முக்கிய காரணங்கள் பின்வருவனவாக இருக்கலாம்: − LIQUATION - (La liquation, Saigerung) - திரவ நிலையிலிருந்து திட நிலைக்கு மாறும்போது உலோகக் கலவைகள் வெவ்வேறு உருகுநிலைகளைக் கொண்ட கூறுகள் அல்லது தனிப்பட்ட சேர்மங்களாக சிதைவடையும் திறன் ஆகும். ; - பாதுகாப்பு படத்தின் பன்முகத்தன்மை; 44 - உடல் நிலைகளின் பன்முகத்தன்மை - உலோகத்தின் வெவ்வேறு பகுதிகளில் சமமற்ற வெப்பநிலை, சிதைந்த பகுதிகள், மன அழுத்தம் செறிவூட்டல்கள்; − எலக்ட்ரோலைட் பன்முகத்தன்மை - ஆக்ஸிஜன் செறிவு அல்லது உப்பு செறிவு வேறுபாடு, வெவ்வேறு pH மதிப்பு. அதிக எதிர்மறை ஆற்றல் கொண்ட பகுதிகள் ANODIC என்றும், அதிக நேர்மறை ஆற்றல் கொண்ட பகுதிகள் CATHODE என்றும் அழைக்கப்படுகின்றன. உலோக மேற்பரப்பின் பன்முகத்தன்மையின் அளவு கேத்தோடு மற்றும் அனோடிக் பிரிவுகளின் சாத்தியக்கூறுகளின் வேறுபாட்டால் தீர்மானிக்கப்படுகிறது. 3.2 மின்வேதியியல் அரிப்பின் வெப்ப இயக்கவியல் அரிப்பு செயல்முறையின் தன்னிச்சையான நிகழ்வுக்கான சாத்தியம் இலவச ஆற்றலின் குறைவால் தீர்மானிக்கப்படுகிறது (ஐசோபாரிக்-சமவெப்ப திறன்) G< 0: G = −nFE < 0, (16) где n – эквивалентное число электронов; Е = К – А – эдс гальванического элемента, образующегося при контакте металла с окислителем в процессе коррозии; К – обратимый потенциал катодной реакции (окислителя); А – обратимый потенциал анодной реакции (металла – восстановителя); F – число Фарадея. Принципиальная возможность протекания процесса электрохимической коррозии металла имеет место при К > A அல்லது E > 0. எலக்ட்ரோலைட்டில் உள்ள ஆக்ஸிஜனேற்ற முகவரின் மீளக்கூடிய ரெடாக்ஸ் திறன் இந்த நிலைமைகளின் கீழ் அதே நிலைமைகளின் கீழ் உள்ள உலோகத்தின் மீளக்கூடிய ஆற்றலை விட நேர்மறையாக இருக்க வேண்டும். உலோகங்களின் மின் வேதியியல் அரிப்புக்கான வெப்ப இயக்கவியல் சாத்தியத்தின் வரம்புகளை நிறுவ, Pourbaix வரைபடங்களைப் பயன்படுத்தலாம். வரைபடங்கள் சமநிலை நிலைகளுக்கான தீர்வின் pH இல் மீளக்கூடிய மின்முனை ஆற்றல்களின் (ஹைட்ரஜன் அளவில் வோல்ட்டுகளில்) சார்புநிலையின் வரைகலை பிரதிநிதித்துவங்கள்: எலக்ட்ரான்களின் பங்கேற்புடன் - கிடைமட்ட கோடுகள்; எலக்ட்ரான்கள் மற்றும் அயனிகளின் பங்கேற்புடன் H+ அல்லது OH– - சாய்ந்த கோடுகள்; H + மற்றும் OH- அயனிகளின் பங்கேற்புடன், ஆனால் எலக்ட்ரான்களின் பங்கேற்பு இல்லாமல் (ஹைட்ரேட் உருவாக்கத்தின் pH மதிப்பு) - செங்குத்து கோடுகள். 45 படம்.9. வரைபடம் E – 25°C இல் Al-H2O அமைப்பிற்கான pH, படம். Al - H2O அமைப்புக்கான Pourbaix வரைபடத்தை படம் 9 காட்டுகிறது. வரைபடத்தின் ஒவ்வொரு பகுதியும் ஒரு வெப்ப இயக்கவியல் நிலையான நிலைக்கு ஒத்திருக்கிறது: உலோக நிலை, கரைசலில் உள்ள அயனிகளின் வடிவத்தில், ஆக்சைடுகள் அல்லது ஹைட்ராக்சைடுகளின் வடிவத்தில். ஒரு கரைசலில் சமநிலையை நிறுவுவது ஹைட்ரஜன் அயனிகளில் மட்டுமல்ல, மற்ற அயனிகளிலும் தங்கியிருப்பதால், பகுதிகளின் வரையறை பல சமநிலைக் கோடுகளால் உருவாகிறது. இந்த வரிகள் ஒவ்வொன்றும் தொடர்புடைய அயனிகளின் குறிப்பிட்ட செயல்பாட்டிற்கு ஒத்திருக்கிறது. வரைபடத்தின் கீழே உள்ள பகுதியில், அலுமினிய உலோகம் வெப்ப இயக்கவியல் ரீதியாக நிலையானது மற்றும் அரிக்காது. கிடைமட்ட கோட்டிற்கு மேலே உள்ள இடது பகுதியில், கரைசலில் Al3+ அயனிகள் வடிவில் உள்ள அலுமினியத்தின் நிலை வெப்ப இயக்கவியல் ரீதியாக நிலையானது. நடுத்தர பகுதி Al2O3 ஆக்சைடு அல்லது Al(OH)3 ஹைட்ராக்சைட்டின் திடமான கட்டங்களின் நிலைத்தன்மைக்கு ஒத்திருக்கிறது, இது அரிப்பு செயல்பாட்டின் போது அலுமினிய மேற்பரப்பில் ஒரு பாதுகாப்பு படத்தை உருவாக்குகிறது. அலுமினியம் கரைசலில் AlO2– அயனி உருவாவதன் மூலம் அரிப்புக்கு உட்படும் நிலைமைகளை வலது பக்கம் வகைப்படுத்துகிறது. 3.3 மின்வேதியியல் அரிப்பின் வழிமுறை எலக்ட்ரோலைட்டுகளில் உள்ள உலோகங்களின் அரிப்பு கால்வனிக் ஜோடிகளின் உருவாக்கத்துடன் ஏற்படுகிறது, அவை அரிப்பு ஜோடிகள் என்று அழைக்கப்படுகின்றன. நீங்கள் துத்தநாகம் மற்றும் இரும்புத் தகடுகளை முறையே, துத்தநாகம் மற்றும் இரும்பு குளோரைடுகளின் கரைசல்களைக் கொண்ட ஒரு பாத்திரத்தில் இறக்கி (படம் 8 இல் உள்ள pH me வரைபடத்தைப் போன்றது) அவற்றை ஒரு வெளிப்புற கடத்தியுடன் இணைத்தால், சுற்றுடன் இணைக்கப்பட்ட ஒரு மில்லிமீட்டர் காண்பிக்கும் மின்சுற்றில் மின்சாரம் இருப்பது. ஒரு கால்வனிக் ஜோடி உருவாகிறது, இதில் துத்தநாகம் ஆக்ஸிஜனேற்றப்பட்டு கரைசலில் (அனோட்) செல்லும். இரும்பு ஆக்சிஜனேற்றம் மற்றும் கரைசலில் செல்லாது, ஏனெனில், துத்தநாகத்துடன் இணைந்தால், அது ஒரு கேத்தோடாக செயல்படுகிறது. துத்தநாகத்துடன் இணைக்கப்படாத இரும்பு, இதேபோன்ற கரைசலில் அரிக்கிறது. நடைமுறையில், உலோகக்கலவைகளில் அதிக எண்ணிக்கையிலான நுண் கூறுகள் மற்றும் வேறுபட்ட உலோகங்கள் உள்ளன. வேறு வார்த்தைகளில் கூறுவதானால், வேறுபட்ட உலோகங்கள் ஒருவருக்கொருவர் மற்றும் எலக்ட்ரோலைட்டுடன் நேரடி தொடர்பில் ஒரே விமானத்தில் அமைந்துள்ளன. இதன் விளைவாக ஒரு மல்டிஎலக்ட்ரோடு செல் உள்ளது, இதில் அனோட்கள் கேத்தோட்களுடன் மாறி மாறி வருகின்றன. அனோடிக் தளங்களில், உலோக அயனிகள் (Men+) கரைசலில் செல்கின்றன. வெளியிடப்பட்ட எலக்ட்ரான்கள் (nē) உலோகத்தின் வழியாக அனோடிலிருந்து கேத்தோடிற்கு நகரும். துருவ நீர் மூலக்கூறுகளுடன் உலோகத்தின் வெளிப்புற மேற்பரப்பில் அமைந்துள்ள அணுக்கள் - அக்வஸ் கரைசல்களில் உலோக அயனிகளின் கரைப்பு அயனிகளின் தொடர்புகளின் விளைவாக குறிப்பிடப்பட வேண்டும். நீர் இருமுனைகளுடன் கரைந்த உலோக அயனிகளின் தொடர்பு மின்னியல் ஈர்ப்பு சக்திகளால் ஏற்படுகிறது. இதன் விளைவாக, ஒவ்வொரு அயனியையும் சுற்றி, அதிக அல்லது குறைந்த அளவிற்கு (அதன் கட்டணத்தின் அளவைப் பொறுத்து), நீர் இருமுனைகளின் ஷெல் உருவாகிறது (நீரேற்றத்தின் நிகழ்வு). நீரேற்றம் காரணமாக, அயனியின் பயனுள்ள ஆரம் அதிகரிக்கிறது, இதன் விளைவாக நீரேற்றப்பட்ட அயனிகளின் இயக்கம் கணிசமாகக் குறைகிறது. நீரேற்றம் செயல்முறை ஆற்றலின் வெளியீட்டுடன் சேர்ந்துள்ளது, அதே நேரத்தில் நீரிழப்பு செயல்முறைக்கு ஆற்றல் தேவைப்படுகிறது. நீர் இருமுனைகளுடன் கூடுதலாக, அயனியை மற்ற இருமுனைகளின் ஷெல் மூலம் மூடலாம். மிகவும் பொதுவான வழக்கில், இந்த நிகழ்வு தீர்வு என்று அழைக்கப்படுகிறது15. எனவே, மின்வேதியியல் அரிப்பு பின்வரும் நிலைகளைக் கொண்டுள்ளது, இது இணையாக நிகழும்: - ஒரு அனோடிக் செயல்முறை, இது மேற்பரப்பில் இருந்து கரைசலுக்கு உலோக அயனிகளை மாற்றுவதையும் அவற்றின் நீரேற்றத்தையும் உள்ளடக்கியது: தீர்வு - ஒரு கரைப்பான் மற்றும் ஒரு கரைப்பான் ஆகியவற்றுக்கு இடையே இணைகளை உருவாக்கும் செயல்முறை. கரைந்த பொருள், தீர்வுக்கான தயாரிப்பு SOLVATE ஆகும். கரைப்பான் நீர் என்றால், ஹைட்ரேஷன், நீரேற்றத்தின் தயாரிப்பு ஹைட்ரேட் ஆகும். 15 47 Meº − nē Men+ + mH2O Men+ mH2O. ஹைட்ரேட் என்பது ஒரு கத்தோடிக் செயல்முறையாகும், இது சில டிபோலரைசர் (D) மூலம் எலக்ட்ரான்களை ஒருங்கிணைப்பதில் (பிடிப்பு) கொண்டுள்ளது: D + nē . அனோடிக் மற்றும் கத்தோடிக் செயல்முறைகள் சுயாதீனமானவை மற்றும் மிகவும் எளிதாக நிகழும் என்பதால்: மேற்பரப்பின் எதிர்மறையான ஆரம்ப ஆற்றல் கொண்ட பகுதிகளில் அனோடிக், மேலும் நேர்மறையானவற்றில் கத்தோடிக் - மற்றும் நடைமுறை நிலைமைகளில் இதற்குத் தேவையான உலோக மேற்பரப்பின் மின் வேதியியல் பன்முகத்தன்மை குறிப்பிட்டது, இந்த செயல்முறைகள் பெரும்பாலும் உள்ளூர்மயமாக்கப்பட்ட முறையில் நிகழ்கின்றன. மின்னோட்டத்தின் ஓட்டம் உலோகத்தின் மீது மேற்கொள்ளப்படுகிறது - அனோடிக் பகுதிகளிலிருந்து கேத்தோடிற்கு எலக்ட்ரான்களின் இயக்கம், மற்றும் கரைசலில், அதே நேரத்தில், அயனிகளின் இயக்கம் ஏற்படுகிறது. எனவே, தற்போதைய வலிமையானது மின்வேதியியல் அரிப்பு விகிதத்திற்கு ஒரு அளவுகோலாக செயல்படும். அனோடின் பொருள் நுகர்வு கணக்கிட, அதாவது. ஃபாரடேயின் சூத்திரத்தைப் பயன்படுத்தி அதன் மேற்பரப்பின் 1 செ.மீ 2 அரிக்கப்பட்ட உலோகத்தின் அளவைப் பயன்படுத்தலாம்: K = Q A / F n = i A / F n, K என்பது அரிக்கப்பட்ட அளவு உலோகம், g/cm2; Q என்பது நேர்மின்முனை மற்றும் கேத்தோடு பிரிவுகளுக்கு இடையே τ, [s] நேரத்தில் பாயும் மின்சாரத்தின் அளவு; i - தற்போதைய அடர்த்தி, A/cm2; எஃப் - ஃபாரடே எண்; n - உலோக வேலன்ஸ்; A என்பது உலோகத்தின் அணு நிறை. 3.4 மின்முனை செயல்முறைகள் மற்றும் அதன் காரணங்களின் துருவமுனைப்பு ஒரு அரிப்பு உறுப்பு மின்முனைகள் குறுகிய சுற்றும் போது, மின்முனை ஆற்றல்களில் குறிப்பிடத்தக்க மாற்றம் ஏற்படுகிறது, ஆனால் ஜோடியின் எதிர்ப்பானது நடைமுறையில் மாறாது. இந்த வழக்கில், அரிப்பு உறுப்புகளின் எலக்ட்ரோமோட்டிவ் சக்தியில் குறைவு காணப்படுகிறது. ஆரம்ப ஆற்றல்களில் ஏற்படும் மாற்றம், அரிப்பு மின்னோட்டத்தில் குறைவதற்கு வழிவகுக்கும், அதன் விளைவாக, அரிப்பு விகிதம், துருவமுனைப்பு என்று அழைக்கப்படுகிறது. அரிப்பு உறுப்பின் செயல்பாட்டின் போது மின்முனைகளின் சாத்தியக்கூறுகளில் ஏற்படும் மாற்றம் (16) கேத்தோடு ஆற்றல் மிகவும் எதிர்மறையாக மாறுவதைக் காட்டுகிறது (கேதோட் துருவமுனைப்பு), மேலும் நேர்மின்வாயில் திறன் மிகவும் நேர்மறையாகிறது (ANODIC POLARIZATION): K = Ko - K, (17) o A = A + A, (18) K மற்றும் A ஆகியவை வேலை செய்யும் உறுப்புகளின் மின்முனைகளின் சாத்தியமான மதிப்புகள்; Кº மற்றும் Аo - சுற்று மூடுவதற்கு முன் மின்முனை ஆற்றல்களின் ஆரம்ப மதிப்புகள்; K மற்றும் A - கேத்தோடு மற்றும் அனோடின் சாத்தியமான இடப்பெயர்ச்சி (துருவமுனைப்பு). இதனால், சாத்தியமான வேறுபாடு E = K - A குறைகிறது. துருவமுனைப்பு என்பது ஒரு குறுகிய சுற்று உறுப்புகளில் எலக்ட்ரான்களின் ஓட்டத்திலிருந்து மின்முனை செயல்முறைகளின் பின்னடைவின் விளைவாகும். ஓமிக் எதிர்ப்புகள் (ஆர்) அரிப்பு மின்னோட்டத்தைக் குறைப்பதில் சிறிய விளைவைக் கொண்டிருக்கின்றன, ஏனெனில் அவை பொதுவாக சிறியதாக இருக்கும். துருவமுனைப்பு எதிர்ப்புகள் மிகவும் முக்கியத்துவம் வாய்ந்தவை, அவை கேத்தோடில் (பிகே) எலக்ட்ரான்களை வெளியேற்றுவதில் உள்ள சிரமங்களுடன் அல்லது உலோக லேட்டிஸிலிருந்து நேர்மறை உலோக அயனிகளை கரைசலுக்கு (பிஏ) மாற்றுவதில் உள்ள சிரமங்களுடன் தொடர்புடையவை. ஓமிக் பரிமாணத்தைக் கொண்ட இந்த எதிர்ப்புகள், மின் வேதியியல் அரிப்பு விகிதம் குறைவதற்கு முக்கிய காரணமாகும். ஓம் விதியின்படி சுற்று மூடும் தருணத்தில் தற்போதைய வலிமை Iinit = (Кº - Аo)/R, (19) சூத்திரத்தால் தீர்மானிக்கப்படுகிறது. அரிப்பு மின்னோட்டத்தின் ஆரம்ப மதிப்பு (Iinit) ஆரம்ப சாத்தியமான மதிப்புகள் Kº மற்றும் Ao இடையே உள்ள வேறுபாட்டிற்கு நேரடியாக விகிதாசாரமாகும், இது Kº > Ao மற்றும் எதிர்ப்பிற்கு நேர்மாறான விகிதாசாரமாக இருக்கும். நிலையான-நிலை அரிப்பு மின்னோட்டம் (Iworking cell) சமன்பாட்டால் தீர்மானிக்கப்படுகிறது: Iworking cell = (K - A)/(R + PA + PK). எனவே, நான் வேலை. எல்-டா< Iнач. Снижению скорости электрохимической коррозии или уменьшению коррозионного тока могут способствовать: − уменьшение степени термодинамической стабильности, т. е. сближение равновесных потенциалов анодного Аº и катодного Кº процессов; − торможение катодных процессов, иначе говоря, увеличение катодной поляризуемости РК; 49 − торможение анодных процессов, то есть увеличение анодной поляризуемости РА. Поляризация является весьма желательным явлением в коррозионных процессах, так как электроды замкнуты накоротко, омическое сопротивление их невелико и, следовательно, не будь поляризационных сопротивлений, коррозия протекла бы весьма интенсивно. Всякое воздействие, уменьшающее поляризацию, увеличивает скорость коррозионных процессов. Факторы, уменьшающие поляризацию электродов коррозионного элемента, называют ДЕПОЛЯРИЗАТОРАМИ, а процессы, протекающие при этом – АНОДНОЙ И КАТОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ. 3.4.1. Анодная поляризация Анодная поляризация обычно оказывает меньшее влияние на изменение разности потенциалов элемента по сравнению с катодной поляризацией. Анодный процесс, заключающийся в ионизации металла и гидратировании ионов по уравнению: Men+ + mH2O → Men+ ∙ mH2O, может протекать беспрепятственно только при условии беспрерывного отвода образующихся ионов из прианодной зоны. Торможение анодного процесса будет иметь место и в случае отставания скорости выхода ионов металла в раствор от скорости перетекания электронов на катодные участки. В результате анодной поляризации отрицательный заряд на металлической обкладке двойного слоя уменьшается, а следовательно, потенциал металла сдвинется в положительную сторону (или станет менее отрицательны). Таким образом, анодная поляризация происходит или в связи с тем, что скорость анодного процесса не поспевает за скоростью отвода электронов (перенапряжение ионизации металла), или потому, что из−за недостаточно быстрого отвода перешедших в раствор ионов металла повышается концентрация этих ионов в прианодной зоне (концентрационная поляризация). Чем легче протекает анодный процесс, тем меньше его поляризуемость. Следить за тем, легко ли протекает анодный процесс или он заметно тормозится, можно по ходу поляризационной анодной кри50 Потенциал, В вой. Эта кривая показывает зависимость потенциала электрода от плотности анодного тока на нем. Такая кривая показана на рис. 10. Удаление продуктов анодной реакции вызывает деполяризацию анода. Деполяризация анода может быть ускорена перемешиЕ Е ванием раствора, образованием о А таких продуктов коррозии, которые выпадают в осадок, а также путем образования комплексных соединений. Вследствие связывания в комплекс ионов металла, перешедших в раствор, концентрация их в прианодной зоне уменьшаПлотность тока, мА/см2 ется; анодная поляризация сниРис. 10. Анодная поляризаци- жается и переход ионов в расонная кривая твор, т.е. коррозия, усиливается. Например, медь и ее сплавы образуют в растворе аммиака хорошо растворимый комплексный ион 2+. Этим объясняется сильная коррозия меди и ее сплавов в аммиачных растворах. Поляризация анодного процесса в обычных условиях происходит в незначительной степени. Исключение представляет случай возникновения анодной пассивности. 3.4.2. Катодная поляризация Протекание катодной реакции могут тормозить два основных процесса: − торможение за счет трудности протекания самой реакции присоединения электрона деполяризатором, т. е. задержка в реакции nē + D (Dnē). Затруднение протекания катодного процесса по этой причине называется ПЕРЕНАПРЯЖЕНИЕМ РЕАКЦИИ КАТОДНОЙ ДЕПОЛЯРИЗАЦИИ; − торможение в процессе подвода к катодной поверхности деполяризатора (D) или отвода от катодной поверхности продуктов восстановления деполяризатора (Dnē). Затруднение катодного процесса по этой причине называется КОНЦЕНТРАЦИОННОЙ ПОЛЯРИЗАЦИЕЙ КАТОДА. 51 Всякий процесс захвата электрона на катоде, т.е. всякий процесс восстановления какого−либо вещества может являться катодной деполяризующей реакцией. Деполяризация катода может протекать различными путями: − ассимиляция электронов ионами: 2H+ +2ē H2, Fe3+ + ē Fe2+, Cu2+ + ē Cu+, S2O8– + ē 2SO42–; − ассимиляция электронов нейтральными молекулами: О2 + 4ē + 2Н2О 4ОН–, Cl2 + 2ē 2Cl–, Н2О2 + 2ē 2ОН–; − ассимиляция электронов нерастворимыми пленками Fe3O4 + 2ē + H2O 3FeO + 2OH–, Fe(OH)3 + ē Fe(OH)2 + OH–; − ассимиляция электронов органическими соединениями RO + 2ē + 4H+ RH2 + H2O, R + 2ē + 2H+ RH2, где R – радикал или органическая молекула. Наиболее часто встречаемыми и наиболее важными катодными деполяризационными процессами являются два: а) разряд и выделение водорода (деполяризатор ион водорода) 2H+ +2ē H2. В этом случае коррозионный процесс называется коррозией с ВОДОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ. Этому виду коррозии подвержены электроотрицательные металлы в кислотах и весьма электроотрицательные металлы, например Mg, в воде и нейтральных растворах электролитов; б) восстановление атомов или молекул кислорода электронами, притекающими на катодных участках − КИСЛОРОДНАЯ ДЕПОЛЯРИЗАЦИЯ: О2 + Н2О + 4ē 4ОН–. Деполяризатором здесь является растворенный в электролите кислород. Этот вид коррозии является наиболее распространенным. Так корродирует большинство металлов в атмосфере, почве, нейтральных растворах электролитов. Иногда оба деполяризующие процесса протекают параллельно, как например, при коррозии железа в разбавленных растворах серной кислоты в присутствии кислорода воздуха. 52 3.4.3. Водородная деполяризация Протекание коррозии металла с водородной деполяризацией возможно, если (Me)обр < (н2)обр. (20) Согласно уравнению Нернста (н2)обр = (н2)ºобр + (RT2,3/F)lg(aH+/pH21/2), (21) о где (н2) обр – стандартный обратимый потенциал водородного электрода при всех температурах (при ан+ = 1 и рН2 = 1 ат); R – универсальная газовая постоянная. Ниже приведены значения обратимого потенциала водородного электрода (н2)обр при 25 оС и различных значениях рН среды и pН2. рн2, ат 5∙10 1 –7 0 + 0,186 0 рН среды 7 − 0,228 − 0,414 14 − 0,641 − 0,828 Изменение потенциала катода при катодной деполяризации выделением водорода подчиняется ближе всего логарифмической зависимости от плотности тока. Эта зависимость определяется выражением: К = Кº – (а + b lg i). (22) Для очень малых плотностей катодного тока (меньше 10–4 – 10–5 А/см2) потенциал от плотности тока имеет линейную зависимость. Поэтому при i = 0 К = Кº, а не бесконечности, как это следует из уравнения. Поляризуемость катода при выделении на нем водорода принято определять ВЕЛИЧИНОЙ ПЕРЕНАПРЯЖЕНИЯ ВОДОРОДА на данном материале катода. Под ПЕРЕНАПРЯЖЕНИЕМ ВОДОРОДА понимают сдвиг потенциала катода при данной плотности тока в отрицательную сторону по сравнению с потенциалом водорода в том же растворе (без наложения тока) и обозначают через η η = − (К − Кº) (23) или η = a + blgI, (24) где b – константа, не зависящая от материала, рассчитывается как 2,3 ∙ 2RT / nF; а − константа, зависит от природы и состояния поверхности материала катода и численно равна величине перенапряжения при плотности тока, равной единице. 53 Поляризационная кривая для случая водородной деполяризации имеет вид кривой Кº MN (рис. 11). − N 1 M η Рис. 11. Катодная поляризационная кривая для процесса водородной деполяризации ко или (н2)обр i1 0 i P Если по оси абсцисс взять не плотность тока, а логарифм этой величины, то кривая перенапряжения будет прямой. В этом случае константа b является тангенсом угла наклона полученной прямой к оси абсцисс, константа а равна величине ординаты lg i = 0 (т.е. при плотности тока i = 1). Величина перенапряжения водорода зависит от плотности тока, т.е. при данной силе тока, от истинных размеров поверхности катода. При одинаковой силе тока она больше на гладкой поверхности, чем на шероховатой. 3.4.4. Кислородная деполяризация Процессы коррозии с КИСЛОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ могут протекать в том случае, если при данных условиях обратимый потенциал металла отрицательнее обратимого потенциала кислородного электрода (Me)обр < (О2)обр. (25) 54 Обратимый потенциал кислородного электрода может быть вычислен по уравнению Нернста: (О2)обр = (О2)ºобр + (RT2,3/4F)lg(pО2/a4ОH−) (26) где (О2)ºобр – стандартный обратимый потенциал кислородного электрода (при аOH– = 1 и рО2 = 1 ат); рО2 – парциальное давление кислорода; аОН– – активность гидроксильных ионов. Величина обратимого потенциала кислородного электрода (О2)ºобр при 25 oC для различных значений рН и рО2: рН среды ро2 , ат 0,21 1 0 + 1,218 + 1,229 7 + 0,805 + 0,815 14 + 0,391 + 0,400 Коррозия с кислородной деполяризацией является термодинамически более возможным процессом, чем коррозия с водородной деполяризацией, так как равновесный потенциал восстановления кислорода более положителен, чем равновесный потенциал выделения водорода. Коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом. Коррозии с кислородной деполяризацией подвергаются металлическая обшивка нефтезаводской аппаратуры и оборудования, детали аппаратов, соприкасающиеся с водой и нейтральными водными растворами солей (например, трубы конденсационно−холодильного оборудования), подземные трубопроводы, днища резервуаров и др. При коррозии металлов с кислородной деполяризацией катодный процесс определяется перенапряжением катодной реакции и скоростью подвода кислорода к электроду. Замедленность катодной реакции по схеме: О2 + 2Н2О + 4е 4ОН– (в щелочных или нейтральных растворах), или по схеме: О2 + 4Н+ + 4е 2Н2О (в слабо−кислых растворах) называется ПЕРЕНАПРЯЖЕНИЕМ ИОНИЗАЦИИ КИСЛОРОДА. При больших плотностях тока (при iк > 10–2 A/m2) மற்றும் கத்தோடிற்கு ஆக்ஸிஜன் வழங்கலின் குறிப்பிடத்தக்க விகிதம், ஆக்ஸிஜன் அயனியாக்கம் மிகை மின்னழுத்தம் தற்போதைய அடர்த்தி 55 δ" = а"+ b" log i, (27) δ" இருக்கும் இடத்தில் மடக்கை சார்ந்துள்ளது. ஆக்ஸிஜன் அயனியாக்கம் அதிக மின்னழுத்தம்; a" என்பது கத்தோட் பொருள் மற்றும் அதன் மேற்பரப்பு நிலை, வெப்பநிலை மற்றும் பிற காரணிகளைச் சார்ந்து இருக்கும் ஒரு மாறிலி ஆகும். இது i = 1 இல் உள்ள அதிக மின்னழுத்த மதிப்பு என எண்ணியல் ரீதியாக வரையறுக்கப்படுகிறது; b" என்பது கேத்தோடு பொருளைச் சார்ந்து இல்லாத மாறிலியாகும்; அது சமத்துவம் b" = 2RT/nF ∙ 2.3; 20° மற்றும் n = 1, b" = 0.117 வெப்பநிலையில் தீர்மானிக்கப்படுகிறது. ஆக்ஸிஜனின் கத்தோடிக் குறைப்பு செயல்முறை மிகவும் சிக்கலானது மற்றும் பல நிலைகளில் நிகழ்கிறது: எலக்ட்ரோலைட்டில் ஆக்ஸிஜனைக் கரைத்தல், உலோகத்தின் கேத்தோடு பிரிவுகளுக்கு கரைந்த ஆக்ஸிஜனை மாற்றுதல், ஆக்ஸிஜனின் அயனியாக்கம். ஹைட்ரஜன் டிபோலரைசேஷனுக்கு மாறாக, செறிவு துருவமுனைப்பு நடைமுறையில் முக்கியமற்றது, ஆக்ஸிஜன் டிப்போலரைசேஷன் கொண்ட உலோகங்களின் அரிப்பில், கேத்தோடிற்கு குறைந்த அளவிலான ஆக்ஸிஜன் வழங்கல் காரணமாக இது மிக முக்கிய பங்கு வகிக்கிறது. எலக்ட்ரோலைட் கரைசலில் ஆக்ஸிஜனின் குறைந்த கரைதிறன் மற்றும் அதன் குறைந்த செறிவு, கேத்தோடிற்கு அருகில் உள்ள திரவத்தின் நிலையான அடுக்கு வழியாக ஆக்ஸிஜன் பரவலின் சிரமம் ஆகியவற்றால் இது விளக்கப்படுகிறது. கரைசலின் வலுவான கிளறி, தீவிர சுழற்சி அல்லது எலக்ட்ரோலைட்டின் குறிப்பிடத்தக்க காற்றோட்டத்தை வழங்கும் நிலைமைகளின் கீழ், ஆக்ஸிஜன் அயனியாக்கத்தின் அதிகப்படியான மின்னழுத்தத்தால் அரிப்பு செயல்முறை தடுக்கப்படுகிறது. மெட்டல் ஒரு அமைதியான அல்லது சிறிது கிளறப்பட்ட கரைசலில் மூழ்கும்போது பரவல் செயல்முறைகள் அரிப்பு விகிதத்தை பாதிக்கின்றன. பொது கத்தோடிக் துருவமுனைப்பு வளைவு ஒரு சிக்கலான வடிவத்தைக் கொண்டுள்ளது (படம். 12) மற்றும் ஆக்ஸிஜன் அயனியாக்கம் (AB), செறிவு துருவமுனைப்பு (DE) மற்றும் ஹைட்ரஜன் அயனிகளின் வெளியேற்றம் (GFH) ஆகியவற்றின் போது துருவமுனைப்பை வகைப்படுத்தும் மூன்று வளைவுகளின் மொத்தமாகும். முதல் பிரிவில், கத்தோடிக் செயல்முறையின் வேகம், அதாவது. ஒரு யூனிட் நேரத்திற்கு குறைக்கப்படும் ஆக்ஸிஜனின் அளவு, பரவல் மூலம் மேற்பரப்புக்கு ஆக்ஸிஜன் விநியோகத்தின் அதிகபட்ச விகிதத்தை விட குறைவாக உள்ளது. இது சம்பந்தமாக, இந்த பகுதியில் செயல்முறையின் வேகம் முக்கியமாக ஆக்ஸிஜன் குறைப்பு செயல்முறையின் மந்தநிலையால் வரையறுக்கப்படுகிறது. 56 − H F K E G (H2)arr 0 (O2)arr A D B C iд i படம். 12 ஆக்ஸிஜன் டிப்போலரைசேஷன் செயல்முறைக்கான கேத்தோடு துருவமுனைப்பு வளைவு தற்போதைய அடர்த்தியில் மேலும் அதிகரிப்புடன், எதிர்மறை திசையில் சாத்தியம் மாறுகிறது, முதலில் படிப்படியாக, பின்னர் திடீரென (CDE பிரிவு). ஆக்ஸிஜன் செறிவு குறைவதால் எதிர்மறையான திசையில் சாத்தியமான ஒரு கூர்மையான மாற்றம் செறிவு துருவமுனைப்புடன் தொடர்புடையது. ஒரு குறிப்பிட்ட சாத்தியமான மதிப்பில், ஒரு புதிய கத்தோடிக் செயல்முறை சாத்தியமாகும், இது பொதுவாக ஹைட்ரஜன் டிபோலரைசேஷன் (பிரிவு EK) உடன் தொடர்புடையது. 3.5 அரிப்புக் காரணியைக் கட்டுப்படுத்துதல் அரிப்பு செயல்முறையின் உண்மையான வேகம் ஒவ்வொரு கட்டத்திலும் அதன் மொத்த தடுப்பை நேரடியாக சார்ந்துள்ளது. அதன் ஒவ்வொரு நிலையிலும் ஒட்டுமொத்த செயல்முறையின் தடுப்பின் சதவீதம், கொடுக்கப்பட்ட கட்டத்தில் செயல்முறைக் கட்டுப்பாட்டின் பட்டத்தை வகைப்படுத்துகிறது. 57 அரிப்பு வீதத்தை நிர்ணயிக்கும் நிலை என்று அழைக்கப்படுகிறது, ஏனெனில் இது மற்ற நிலைகளுடன் ஒப்பிடும்போது மிகப்பெரிய எதிர்ப்பைக் கொண்டுள்ளது. செயல்முறையை கட்டுப்படுத்துதல் o2)arr imax I imax b b b a (o2)arr I I S (о2)arr i I g g d d படம். 13. மின்வேதியியல் அரிப்பு செயல்முறைகளை கண்காணிப்பதற்கான முக்கிய நடைமுறை நிகழ்வுகளுக்கான துருவமுனைப்பு அரிப்பு வரைபடங்கள் 58 I நடைமுறை நிலைமைகளில், உலோகங்கள் மற்றும் உலோகக்கலவைகளின் மின்வேதியியல் அரிப்பைக் கண்காணிக்கும் பல அடிப்படை நிகழ்வுகள் உள்ளன, இது N.D ஆல் நிரூபிக்கப்பட்டுள்ளது. டோமாஷோவ். Bekkerev I.V "உலோகங்கள் மற்றும் கலவைகள் - தரங்கள், இரசாயன கலவை", பகுதி 2, Ulyanovsk: Ulyanovsk மாநில தொழில்நுட்ப பல்கலைக்கழகம், 2007. - ப. 630, http://www.bibliotekar.ru/spravochnik-73/index.htm. 3]. செமனோவா ஐ.வி. அரிப்பு மற்றும் அரிப்பு பாதுகாப்பு, எம்.: ஃபிஸ்மாட்லிட், 2002, 335 ப. 4]. கல்தேவ் ஜி.வி., போரிசோவா டி.எஃப். மின் வேதியியல்" - தொகுதி 30, மாஸ்கோ, 1989 பக். 232 5]. T. L. Lukanina, T. T. Ovchinnikova, V. யா, "பொது வேதியியல்" பகுதி II. பயிற்சி. 2வது பதிப்பு, திருத்தப்பட்டு விரிவாக்கப்பட்டது, 2006)