Շինանյութերի քիմիական դիմադրությունը՝ կախված դրանց կազմից և կառուցվածքից: Նյութերի տեխնոլոգիական հատկություններ. Նյութերի քիմիական դիմադրություն Վլադիսլավ Ալեքսանդրովիչ Լիխաչև x Աշխատանքի հիմնական ընթացքը
Ընդհանուր և մասնագիտական կրթության նախարարություն
Ռուսաստանի Դաշնություն
ՄՈՍԿՎԱՅԻ ՊԵՏԱԿԱՆ ԲՆԱՊԱՀՊԱՆԱԿԱՆ ՃԱՐՏԱՐԱԳԻՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ
A.G.Parshin V.S.Pakhomov D.L.Lebedev
Նյութերի քիմիական դիմադրություն և կոռոզիայից պաշտպանություն
Լաբորատոր արտադրամաս
Խմբագրվել է դոկտոր տեխ. Գիտություններ Ա.Ա.Շևչենկո
Մոսկվա-1998 թ
BBK35.11 x 46
Գրախոսներ.
Մոսկվայի Նավթի և գազի պետական ակադեմիայի կոռոզիայի ամբիոն անվ. Գուբկին;
բ.գ.թ. տեխ. Գիտություններ Ա.Ս. Աբրամով, «ՇանԷկո» բնապահպանական ընկերություն, Մոսկվա.
Որպես ուսումնաօժանդակ հաստատված է Մոսկվայի բնապահպանական ճարտարագիտության պետական համալսարանի խմբագրական և հրատարակչական խորհրդի կողմից:
Պարշին Ա.Գ., Պախոմով Վ.Ս., Լեբեդև Դ.Լ.
Χ 46 Նյութերի քիմիական դիմադրություն և կոռոզիայից պաշտպանություն. Լաբորատոր արտադրամաս / Ed. A.A. Shevchenko - M.: MSUIE, 1998.-80 էջ; հիվանդ.8.
ISBN 5-230-11142-9
Արտադրամասը պարունակում է չորս լաբորատոր աշխատանք էլեկտրաքիմիական կոռոզիայից և մետաղների պաշտպանության վերաբերյալ. «Կառուցվածքային տարասեռության ազդեցությունը մետաղների կոռոզիայի վրա ջրածնի իոնների կրճատման ժամանակ», «Մետաղների կոռոզիան թթվածնի ապաբևեռացումով», «Էլեկտրոդային պոտենցիալներ», «Կոնտակտային կոռոզիա». և մետաղների կաթոդային պաշտպանություն կոռոզիայից»: Նախանշված են մետաղների էլեկտրաքիմիական կոռոզիայի տեսության հիմնական հասկացությունները և կոռոզիոն հետազոտությունների անցկացման մեթոդաբանությունը։ Նախատեսված է նյութերի քիմիական դիմադրության և կոռոզիայից պաշտպանության դասընթացն ուսումնասիրող 3-րդ և 4-րդ կուրսերի մշտական ուսանողների համար:
ISBN 5-230-11142-9 UDC620.193 BBK 35.11
© A.G.Parshin, V.S.Pakhomov, D.L.Lebedev.1998 թ.
© MSUIE, 1998 թ
Նախաբան
Լաբորատոր սեմինարը գրված է մի շարք մասնագիտությունների ծրագրով նախատեսված «Նյութերի քիմիական դիմադրություն և կոռոզիայից պաշտպանություն» կուրսային ծրագրին համապատասխան: Սեմինարը ներառում էր մետաղների էլեկտրաքիմիական կոռոզիայի վերաբերյալ աշխատանք, որը մշակվել էր կոմպոզիտային նյութերի և կոռոզիայից պաշտպանության բաժնում:
Յուրաքանչյուր լաբորատոր աշխատանք սկսվում է տեսական մասից։ Դիտարկված են կոռոզիայի մեխանիզմը, թերմոդինամիկան և կինետիկան ջրածնի իոնների կաթոդային նվազման, թթվածնի ապաբևեռացման, հավասարակշռության և ոչ հավասարակշռության պրոցեսների ընթացքում մետաղ-էլեկտրոլիտ միջերեսում և էլեկտրոդների պոտենցիալների տեսությունը:
Տեսական խնդիրներ ներկայացնելիս օգտագործվում են ժամանակակից էլեկտրաքիմիական հասկացություններ կոռոզիոն պրոցեսների մեխանիզմի և կինետիկայի մասին։
Լաբորատոր աշխատանքների կատարումը թույլ է տալիս ուսանողներին ավելի լավ հասկանալ կոռոզիայից և մետաղների պաշտպանության ուսումնասիրության հիմունքները, ինչպես նաև հմտություններ են սերմանում հիմնական լաբորատոր կոռոզիոն-էլեկտրաքիմիական հետազոտություններ իրականացնելու համար:
Լաբորատոր ամսագրի վարում
1) աշխատանքի անվանումը և նպատակը.
2) տեղադրման դիագրամ.
3) աղյուսակ՝ փորձերի արդյունքներով և դրանց մշակմամբ (հաշվարկներ, գրաֆիկներ).
4) եզրակացություններ.
Ամսագիրը պետք է պահվի կոկիկ և անմիջապես մաքուր, այսինքն. նույն կերպ, ինչպես պահվում են բոլոր հետազոտական և թեստային գործողությունների գրառումները:
Տեղադրման դիագրամը պետք է լինի պարզ և հասկանալի առանց բանավոր բացատրությունների:
Անհրաժեշտ է ապահովել փորձնական պայմաններ՝ փորձարկված նյութեր, նմուշների մակերեսը, էլեկտրոլիտների բաղադրությունը և կոնցենտրացիան, ջերմաստիճանը և այլն:
Փորձարկման արդյունքները պետք է գրանցվեն նախապես կազմված աղյուսակներում, որոնց ձևերը տրված են աշխատանքի նկարագրության մեջ:
Տարբեր քանակություններ գրանցելիս անհրաժեշտ է նշել դրանց չափը։ Չափումների արդյունքները, որպես կանոն, ենթակա են լրացուցիչ մշակման՝ վերլուծական և գրաֆիկական (կոռոզիայի զանգվածի, ծավալի և խորության ցուցիչներ, պոտենցիալների հաշվարկ և այլն)։ Այս դեպքերում անհրաժեշտ է տրամադրել հաշվարկի բանաձևը և մեկ հաշվարկ ամբողջությամբ, այսինքն. փորձնական արժեքները բանաձևի մեջ փոխարինելով, իսկ նմանատիպ այլ հաշվարկների համար՝ միայն վերջնական արդյունքները:
Ձեռք բերված և համապատասխան մշակված արդյունքների հիման վրա պետք է հակիրճ եզրակացություններ արվեն կատարված աշխատանքի վերաբերյալ։ Ավարտելուց հետո փորձնական տվյալներով ամսագիրը ներկայացրեք ուսուցչին՝ վիզա ստանալու համար:
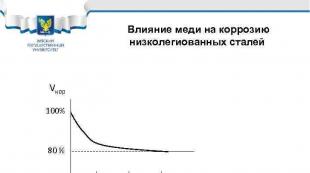
 Պղնձի ազդեցությունը ցածր լեգիրված պողպատների կոռոզիայի վրա Vcor 100% 80% 0. 1 0. 2 0. 3% Cu Պողպատների օրինակներ՝ 10 HSND, 10 G 2 S 1 D, 10 KhDNP, 09 G 2 D, 18 G 2 AF(D)
Պղնձի ազդեցությունը ցածր լեգիրված պողպատների կոռոզիայի վրա Vcor 100% 80% 0. 1 0. 2 0. 3% Cu Պողպատների օրինակներ՝ 10 HSND, 10 G 2 S 1 D, 10 KhDNP, 09 G 2 D, 18 G 2 AF(D)
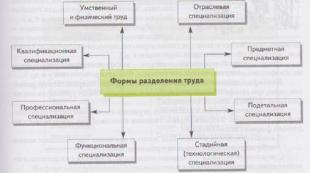
 Կոռոզիոն դիմացկուն պողպատների դասակարգում 1. Կոռոզիակայուն (չժանգոտվող) պողպատները և համաձուլվածքները այն նյութերն են, որոնք դիմադրում են էլեկտրաքիմիական կոռոզիային էլեկտրոլիտներում: 2. Կոռոզիոն դիմացկուն համաձուլվածքի հիմնական համաձուլվածքային տարրը քրոմն է: 3. Չժանգոտվող պողպատների մեջ քրոմը ներմուծվում է Թամմանի կանոնին համապատասխան։ 4. Կախված այն միջավայրից, որտեղ օգտագործվում են այդ պողպատները, առանձնանում են կոռոզիակայուն (չժանգոտվող) պողպատների և համաձուլվածքների հինգ խումբ.
Կոռոզիոն դիմացկուն պողպատների դասակարգում 1. Կոռոզիակայուն (չժանգոտվող) պողպատները և համաձուլվածքները այն նյութերն են, որոնք դիմադրում են էլեկտրաքիմիական կոռոզիային էլեկտրոլիտներում: 2. Կոռոզիոն դիմացկուն համաձուլվածքի հիմնական համաձուլվածքային տարրը քրոմն է: 3. Չժանգոտվող պողպատների մեջ քրոմը ներմուծվում է Թամմանի կանոնին համապատասխան։ 4. Կախված այն միջավայրից, որտեղ օգտագործվում են այդ պողպատները, առանձնանում են կոռոզիակայուն (չժանգոտվող) պողպատների և համաձուլվածքների հինգ խումբ.
 Մեղմ ագրեսիվ միջավայրերի համար կոռոզիակայուն պողպատներ Առաջին խմբի պողպատները կարող են աշխատել միայն փակ մթնոլորտում և ստորջրյա կոռոզիայից՝ պարտադիր պարբերական չորացումով: Բաց մթնոլորտի և մշտական ստորջրյա կոռոզիայի (հատկապես տաք ջրում), ինչպես նաև ստորգետնյա կոռոզիայի պայմաններում այս պողպատները ենթակա են փոսային կոռոզիայի։ Այս պողպատները ներառում են քրոմային պողպատներ՝ 08 X 13, 09 X 13, 08 X 17 G (ֆերիտիկ), 10 X 13, 12 X 13 (մարտենզիտ-ֆերիտիկ), 20 X 13, 30 X 13, 40 X 13 (մարտենսիտ): Ինչպես նաև նիկելի տնտեսական համաձուլվածքով քրոմ-մանգանային և քրոմ-նիկելային պողպատներ (2 -4%) 15 X 17 AG 14, 10 X 14 AG 15, 10 X 14 G 14 N 3 T, 12 X 17 G 14 N 3 , 08 X 18 G 8 N 2 Տ
Մեղմ ագրեսիվ միջավայրերի համար կոռոզիակայուն պողպատներ Առաջին խմբի պողպատները կարող են աշխատել միայն փակ մթնոլորտում և ստորջրյա կոռոզիայից՝ պարտադիր պարբերական չորացումով: Բաց մթնոլորտի և մշտական ստորջրյա կոռոզիայի (հատկապես տաք ջրում), ինչպես նաև ստորգետնյա կոռոզիայի պայմաններում այս պողպատները ենթակա են փոսային կոռոզիայի։ Այս պողպատները ներառում են քրոմային պողպատներ՝ 08 X 13, 09 X 13, 08 X 17 G (ֆերիտիկ), 10 X 13, 12 X 13 (մարտենզիտ-ֆերիտիկ), 20 X 13, 30 X 13, 40 X 13 (մարտենսիտ): Ինչպես նաև նիկելի տնտեսական համաձուլվածքով քրոմ-մանգանային և քրոմ-նիկելային պողպատներ (2 -4%) 15 X 17 AG 14, 10 X 14 AG 15, 10 X 14 G 14 N 3 T, 12 X 17 G 14 N 3 , 08 X 18 G 8 N 2 Տ
 Կոռոզիակայուն (չժանգոտվող) պողպատներ աղի միջավայրի համար Կոռոզիակայուն (չժանգոտվող) պողպատների երկրորդ խումբն օգտագործվում է ցածր ջերմաստիճանի աղի միջավայրում, մասնավորապես ծովային կոռոզիայի ժամանակ: Կոռոզիոն դիմադրության բարձրացումը ձեռք է բերվում Ni պողպատների լրացուցիչ տնտեսական համաձուլման միջոցով (5 – 8%): Օրինակ.
Կոռոզիակայուն (չժանգոտվող) պողպատներ աղի միջավայրի համար Կոռոզիակայուն (չժանգոտվող) պողպատների երկրորդ խումբն օգտագործվում է ցածր ջերմաստիճանի աղի միջավայրում, մասնավորապես ծովային կոռոզիայի ժամանակ: Կոռոզիոն դիմադրության բարձրացումը ձեռք է բերվում Ni պողպատների լրացուցիչ տնտեսական համաձուլման միջոցով (5 – 8%): Օրինակ.
 Պողպատներ միջին քայքայիչ միջավայրում օգտագործելու համար Միջին քայքայիչ միջավայրում նշանակում են տարբեր ջերմաստիճանների աղերի լուծույթներ, ինչպես նաև որոշ թթուների թույլ լուծույթներ: Երրորդ խմբի պողպատները լայն կիրառմամբ ամենատարածված չժանգոտվող պողպատներն են: Այս պողպատներից կարելի է առանձնացնել՝ ա) պողպատներ՝ բարձր նիկելային պողպատների փոխարինիչներ՝ 15 X 25 T, 15 X 28, 08 X 22 N 6 T, 12 X 21 N 5 T։ բ) քրոմից նիկելի օպտիմալ պարունակությամբ պողպատներ։ հարաբերակցությունը (Cr: Ni = 18: 9, 18: 10): 12 X 18 N 9 T և 12 X 18 N 10 T, 17 X 18 N 9, 12 X 18 N 10 B, 08 X 18 N 10, 12 X 18 N 12 T, 08 X 18 N 12 B, 06 X 18 N 11 և այլն:
Պողպատներ միջին քայքայիչ միջավայրում օգտագործելու համար Միջին քայքայիչ միջավայրում նշանակում են տարբեր ջերմաստիճանների աղերի լուծույթներ, ինչպես նաև որոշ թթուների թույլ լուծույթներ: Երրորդ խմբի պողպատները լայն կիրառմամբ ամենատարածված չժանգոտվող պողպատներն են: Այս պողպատներից կարելի է առանձնացնել՝ ա) պողպատներ՝ բարձր նիկելային պողպատների փոխարինիչներ՝ 15 X 25 T, 15 X 28, 08 X 22 N 6 T, 12 X 21 N 5 T։ բ) քրոմից նիկելի օպտիմալ պարունակությամբ պողպատներ։ հարաբերակցությունը (Cr: Ni = 18: 9, 18: 10): 12 X 18 N 9 T և 12 X 18 N 10 T, 17 X 18 N 9, 12 X 18 N 10 B, 08 X 18 N 10, 12 X 18 N 12 T, 08 X 18 N 12 B, 06 X 18 N 11 և այլն:
 Պողպատներ՝ բարձր քայքայիչ միջավայրում օգտագործելու համար Այս տեսակի պողպատները մշակվել են տաք Na լուծույթներում քիմիական դիմադրությունը բարձրացնելու համար: Cl և թթվային լուծույթներում: Պողպատների դիմադրությունը բարձրացնելու համար օգտագործվում է լրացուցիչ համաձուլում մոլիբդենի և պղնձի հետ, և այս խմբի պողպատներում նրանք հաճախ ձգտում են պահպանել աուստենիտիկ կառուցվածք, ինչը հարմար է տեխնոլոգիական առումով, ինչը պահանջում է պողպատների լրացուցիչ համաձուլում նիկելով: Լեգիրային բաղադրիչների, հիմնականում նիկելի բարձր պարունակության պատճառով այս խմբի պողպատները բավականին թանկ են։ Խմբի պողպատների օրինակներն են՝ 10 X 17 N 13 M 2 T 08 X 17 N 13 M 3 T, 08 X 17 N 15 M 3 T, 04 X 28 MDT, 03 X 28 MDT, 06 X 28 MT:
Պողպատներ՝ բարձր քայքայիչ միջավայրում օգտագործելու համար Այս տեսակի պողպատները մշակվել են տաք Na լուծույթներում քիմիական դիմադրությունը բարձրացնելու համար: Cl և թթվային լուծույթներում: Պողպատների դիմադրությունը բարձրացնելու համար օգտագործվում է լրացուցիչ համաձուլում մոլիբդենի և պղնձի հետ, և այս խմբի պողպատներում նրանք հաճախ ձգտում են պահպանել աուստենիտիկ կառուցվածք, ինչը հարմար է տեխնոլոգիական առումով, ինչը պահանջում է պողպատների լրացուցիչ համաձուլում նիկելով: Լեգիրային բաղադրիչների, հիմնականում նիկելի բարձր պարունակության պատճառով այս խմբի պողպատները բավականին թանկ են։ Խմբի պողպատների օրինակներն են՝ 10 X 17 N 13 M 2 T 08 X 17 N 13 M 3 T, 08 X 17 N 15 M 3 T, 04 X 28 MDT, 03 X 28 MDT, 06 X 28 MT:
 Նիկելի վրա հիմնված համաձուլվածքներ շատ ագրեսիվ միջավայրերի համար Շատ բարձր ագրեսիվությամբ կրիչները հասկացվում են որպես ծծմբական և աղաթթուների տաք լուծույթներ: Նման ագրեսիվ միջավայրերում ամենադիմացկուն մետաղական նյութերը նիկելի վրա հիմնված համաձուլվածքներն են: Օրինակ, KhN 65 MV համաձուլվածքը կայուն է բարձր ջերմաստիճաններում ծծմբային և աղաթթվային միջավայրերում, խտացված քացախաթթվի մեջ: Համաձուլվածք N 70 MF-ը խորհուրդ է տրվում օգտագործել ծծմբային և աղաթթվի լուծույթներում, համաձուլվածքն ավելի դիմացկուն է միջգրիտային կոռոզիայից:
Նիկելի վրա հիմնված համաձուլվածքներ շատ ագրեսիվ միջավայրերի համար Շատ բարձր ագրեսիվությամբ կրիչները հասկացվում են որպես ծծմբական և աղաթթուների տաք լուծույթներ: Նման ագրեսիվ միջավայրերում ամենադիմացկուն մետաղական նյութերը նիկելի վրա հիմնված համաձուլվածքներն են: Օրինակ, KhN 65 MV համաձուլվածքը կայուն է բարձր ջերմաստիճաններում ծծմբային և աղաթթվային միջավայրերում, խտացված քացախաթթվի մեջ: Համաձուլվածք N 70 MF-ը խորհուրդ է տրվում օգտագործել ծծմբային և աղաթթվի լուծույթներում, համաձուլվածքն ավելի դիմացկուն է միջգրիտային կոռոզիայից:
 Բետոնի խտության ավելացում 4. Պոլիմերային հավելումների ներմուծում 4. 1. 0,2 - 3% պոլիմերային հավելումների փոքր քանակի ներմուծում կոնկրետ խառնուրդի մեջ (լատեքսներ, պոլիմերային խեժեր); 4. 2. պոլիմերային կապի (պոլիմերային լուծույթներ և պոլիմերային բետոն) հիման վրա բետոնի արտադրություն. Տրվում է որպես չոր խառնուրդ և կարծրացուցիչ՝ բանկաների մեջ: 4. 3. պատրաստի բետոնի և երկաթբետոնե արտադրանքի ներծծում պոլիմերային միացություններով կամ մոնոմերներով դրանց հետագա պոլիմերացումով անմիջապես բետոնե մարմնում (բետոնե պոլիմերներ). 4. 4. բետոնի ամրացում պոլիմերային մանրաթելերով (մանրաթելային բետոնի արտադրություն)
Բետոնի խտության ավելացում 4. Պոլիմերային հավելումների ներմուծում 4. 1. 0,2 - 3% պոլիմերային հավելումների փոքր քանակի ներմուծում կոնկրետ խառնուրդի մեջ (լատեքսներ, պոլիմերային խեժեր); 4. 2. պոլիմերային կապի (պոլիմերային լուծույթներ և պոլիմերային բետոն) հիման վրա բետոնի արտադրություն. Տրվում է որպես չոր խառնուրդ և կարծրացուցիչ՝ բանկաների մեջ: 4. 3. պատրաստի բետոնի և երկաթբետոնե արտադրանքի ներծծում պոլիմերային միացություններով կամ մոնոմերներով դրանց հետագա պոլիմերացումով անմիջապես բետոնե մարմնում (բետոնե պոլիմերներ). 4. 4. բետոնի ամրացում պոլիմերային մանրաթելերով (մանրաթելային բետոնի արտադրություն)

 Մոդուլ 7. Մետաղները էլեկտրաքիմիական կոռոզիայից պաշտպանելու մեթոդներ. Դասախոսություն 7. 3 ՄԵՏԱՂՆԵՐԻ ԷԼԵԿՏՐԱՔԻՄԻԱԿԱՆ ՊԱՇՏՊԱՆՈՒԹՅՈՒՆԸ ԿՈՐՈԶԻԱՅԻՑ Կաթոդիկ պաշտպանությունը բաղկացած է կոռոզիայից կառույցի մետաղի պոտենցիալը բացասական կողմ տեղափոխելուց՝ այն միացնելով հոսանքի աղբյուրի բացասական բևեռին:
Մոդուլ 7. Մետաղները էլեկտրաքիմիական կոռոզիայից պաշտպանելու մեթոդներ. Դասախոսություն 7. 3 ՄԵՏԱՂՆԵՐԻ ԷԼԵԿՏՐԱՔԻՄԻԱԿԱՆ ՊԱՇՏՊԱՆՈՒԹՅՈՒՆԸ ԿՈՐՈԶԻԱՅԻՑ Կաթոդիկ պաշտպանությունը բաղկացած է կոռոզիայից կառույցի մետաղի պոտենցիալը բացասական կողմ տեղափոխելուց՝ այն միացնելով հոսանքի աղբյուրի բացասական բևեռին:
 Մոդուլ 7. Մետաղները էլեկտրաքիմիական կոռոզիայից պաշտպանելու մեթոդներ. Դասախոսություն 7. 3 Կաթոդիկ պաշտպանության կոռոզիոն դիագրամ
Մոդուլ 7. Մետաղները էլեկտրաքիմիական կոռոզիայից պաշտպանելու մեթոդներ. Դասախոսություն 7. 3 Կաթոդիկ պաշտպանության կոռոզիոն դիագրամ
 Մոդուլ 7. Մետաղները էլեկտրաքիմիական կոռոզիայից պաշտպանելու մեթոդներ. Դասախոսություն 7. 2 Պաշտպանական պաշտպանությունը հիմնված է շփման մեջ գտնվող երկու մետաղների կոռոզիայի բնութագրերի վրա: Կոնտակտային կոռոզիայի տեսության համաձայն, երբ դրական մետաղը M 2 շփվում է ավելի բացասական M 1 մետաղի հետ, մետաղի M 2 պոտենցիալը տեղափոխվում է բացասական կողմ, և դրա կոռոզիան նվազում է կամ ամբողջովին դադարում:
Մոդուլ 7. Մետաղները էլեկտրաքիմիական կոռոզիայից պաշտպանելու մեթոդներ. Դասախոսություն 7. 2 Պաշտպանական պաշտպանությունը հիմնված է շփման մեջ գտնվող երկու մետաղների կոռոզիայի բնութագրերի վրա: Կոնտակտային կոռոզիայի տեսության համաձայն, երբ դրական մետաղը M 2 շփվում է ավելի բացասական M 1 մետաղի հետ, մետաղի M 2 պոտենցիալը տեղափոխվում է բացասական կողմ, և դրա կոռոզիան նվազում է կամ ամբողջովին դադարում:
 Մոդուլ 7. Մետաղները էլեկտրաքիմիական կոռոզիայից պաշտպանելու մեթոդներ. Դասախոսություն 7. 3 Անոդային պաշտպանությունը օգտագործվում է միայն քայքայիչ միջավայրում պասիվացման հակված մետաղների համար: Դա պայմանավորված է արտաքին հոսանքի աղբյուրի միջոցով մետաղական ներուժի ակտիվ տարրալուծման շրջանից պասիվացման շրջան տեղափոխելուն:
Մոդուլ 7. Մետաղները էլեկտրաքիմիական կոռոզիայից պաշտպանելու մեթոդներ. Դասախոսություն 7. 3 Անոդային պաշտպանությունը օգտագործվում է միայն քայքայիչ միջավայրում պասիվացման հակված մետաղների համար: Դա պայմանավորված է արտաքին հոսանքի աղբյուրի միջոցով մետաղական ներուժի ակտիվ տարրալուծման շրջանից պասիվացման շրջան տեղափոխելուն:
 Մոդուլ 7. Մետաղները էլեկտրաքիմիական կոռոզիայից պաշտպանելու մեթոդներ. Դասախոսություն 7. 3 Անոդային պաշտպանության կոռոզիայից դիագրամ
Մոդուլ 7. Մետաղները էլեկտրաքիմիական կոռոզիայից պաշտպանելու մեթոդներ. Դասախոսություն 7. 3 Անոդային պաշտպանության կոռոզիայից դիագրամ
ՌՈՒՍԱՍՏԱՆԻ ԿՐԹՈՒԹՅԱՆ ԵՎ ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅՈՒՆ ԲԱՐՁՐԱԳՈՒՅՆ ՄԱՍՆԱԳԻՏԱԿԱՆ ԿՐԹՈՒԹՅԱՆ ԴԱՇՆԱԿԱՆ ՊԵՏԱԿԱՆ ԿՐԹԱԿԱՆ ՀԱՍՏԱՏՈՒԹՅՈՒՆ «ՍԱՆԿՏ ՊԵՏԵՐԲՈՒՐԳԻ ՊՈԼԻՄԵՐՆԵՐԻ ՊԵՏԱԿԱՆ ՏԵԽՆՈԼՈԳԻԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ» Տ.Լ ՆՅՈՒԹԵՐԻ ԵՎ ԿՈՌՈԶԻԱՅԻՑ ՊԱՇՏՊԱՆՈՒԹՅԱՆ ԵԽ Դասագիրք Սանկտ Պետերբուրգ 2014 1 UDC 546(075) BBK 24.1я7 L 840 Lukanina T. L., Mikhailova I. S., Radin M. A. Նյութերի քիմիական դիմադրություն և կոռոզիայից պաշտպանություն. դասագիրք: ձեռնարկ − Սանկտ Պետերբուրգ: SPbGTURP, 2014. – 85 էջ. Ձեռնարկը ժամանակակից պատկերացումներ է տալիս քիմիական կոռոզիայի թերմոդինամիկայի և կինետիկայի, մեխանիզմների և էլեկտրաքիմիական կոռոզիայի տարբեր տեսակների մասին՝ հաշվի առնելով քիմիական արդյունաբերության սարքավորումներին բնորոշ միջավայրերն ու պայմանները: Նախանշված են կոռոզիակայուն պողպատների և համաձուլվածքների ստեղծման գիտական սկզբունքները և կառուցվածքային նյութերը կոռոզիայից պաշտպանելու մեթոդները: Դասագիրքն առաջարկվում է տեխնիկական բուհերի և տեխնոլոգիական մասնագիտություններով սովորող ֆակուլտետների ուսանողների համար։ Կարող է օգտակար լինել ասպիրանտների, քիմիական ձեռնարկությունների գիտական և ճարտարագիտական աշխատողների, նախագծային և հետազոտական կազմակերպությունների համար, որոնք զբաղվում են մետաղների կոռոզիայից պաշտպանությամբ: Գրախոսներ՝ դոկտոր Քիմ. գիտությունների, պրոֆ. Սանկտ Պետերբուրգի պետական ITMO քիմ. Slobodov A. A. ֆակուլտետ; բ.գ.թ. քիմ. գիտություններ, դոց Թուրքմենստանի Սանկտ Պետերբուրգի պետական տեխնիկական համալսարանի օրգանական քիմիայի ամբիոն, Եվդոկիմով Ա. Խմբագիր և սրբագրիչ T. A. Smirnova Tech. Խմբագիր L.Ya Titova Templan 2014, pos. 45 ________________________________________________________________ Տպագրման է ներկայացվել 14.04.14 Ձևաչափ 60×84/16: Թղթի տեսակը թիվ 1. Օֆսեթ տպագրություն. Տպել թերթ 5.5. Ուխ.-խմբ. 100 տպաքանակ. Ivana Chernykh, 4 Սանկտ Պետերբուրգի Բույսերի պոլիմերների պետական տեխնոլոգիական համալսարան, 2014 Lukanina T. L., Mikhailova I. S., Radin M. A., 2014 2 ՆԵՐԱԾՈՒԹՅՈՒՆ Նյութերի կոռոզիան ինքնաբուխ ոչնչացումն է շրջակա միջավայրի հետ քիմիական կամ էլեկտրաքիմիական փոխազդեցության պատճառով: Կոռոզիայի հետևանքով մետաղների և համաձուլվածքների ոչնչացումը տարբերվում է ինքնաբուխ ոչնչացման այլ տեսակներից, ինչպիսիք են էրոզիան կամ մաշվածությունը, որոնք առաջանում են մարմնի կամ շրջակա միջավայրի հետ մեխանիկական փոխազդեցությունից: Մետաղների և համաձուլվածքների մեծ մասի համար շահագործման պայմաններում ավելի կայուն է օքսիդացված (իոնային) վիճակը, որի մեջ նրանք անցնում են կոռոզիայի հետևանքով։ «Կոռոզիա» տերմինը առաջացել է լատիներեն «corrodere» բառից, որը նշանակում է «կոռոզիայի ենթարկել»։ Կորոզիայից առաջացած կորուստները սովորաբար բաժանվում են ուղղակի և անուղղակի: ՈՒՂԻՂ ԿՈՐՈՒՍՆԵՐԸ ներառում են՝ - մետաղի արժեքը, որը վերածվում է կոռոզիոն արտադրանքի, ինչպես նաև կոռոզիայից առաջացած սարքավորումների արժեքը, որը խափանում է մինչև տեխնիկական պայմաններով նախատեսված մաշվածության ժամկետի սպառումը: Ավելին, որպես կանոն, սարքավորումների արտադրության արժեքը զգալիորեն գերազանցում է մետաղի արժեքը, որից այն պատրաստված է. - կոռոզիայի թույլատրելիության ավելացում, ինչը հանգեցնում է ոչ միայն մետաղի սպառման ավելացման, այլև դիզայնի վատթարացման: Օրինակ, նույն արտաքին տրամագծով խողովակաշարի համար մետաղի ավելացված չափը հանգեցնում է օգտակար խաչմերուկի նվազմանը և, հետևաբար, խողովակի թողունակության նվազմանը. - պաշտպանիչ միջոցառումների ծախսերը մետաղական և ոչ մետաղական ծածկույթների, կոռոզիակայուն նյութերի, արգելակիչների և այլնի տեսքով: Կոռոզիայից ԱՆՈՒՂԻՂ ԿՈՐՈՒՍՆԵՐԸ պայմանավորված են հետևյալ պատճառներով. - թերարտադրությունը կոռոզիայից վնասված սարքավորումների վերանորոգման կանգառների արդյունքում. - վթարների, պայթյունների և հրդեհների հավանականությունը. - արտադրանքի արտահոսք՝ կոռոզիայի հետևանքով սարքավորումների պատերին անցքերի ձևավորման պատճառով. 3 – խողովակաշարերի խաչմերուկի կրճատում կոռոզիոն արտադրանքի նստվածքի արդյունքում, որը պահանջում է լրացուցիչ էներգիայի սպառում՝ հեղուկի հոսքի պահանջվող հզորությունը պահպանելու համար. - արտադրանքի որակի նվազում՝ կոռոզիոն արտադրանքներով աղտոտվածության հետևանքով: Կոռոզիայից և մետաղների պաշտպանության գիտությունը ուսումնասիրում է մետաղների և համաձուլվածքների փոխազդեցությունը քայքայիչ միջավայրի հետ, սահմանում է այդ փոխազդեցության մեխանիզմը և դրա ընդհանուր սկզբունքները։ Մետաղների կոռոզիայից և պաշտպանությունից ուսումնասիրելու գիտական հիմքը մետաղագիտությունն է և ֆիզիկական քիմիան։ Այս գիտության վերջնական գործնական նպատակն է պաշտպանել մետաղների քայքայիչ ոչնչացումից՝ դրանց մշակման և սարքավորումների շահագործման ընթացքում: Գլուխ 1. ԸՆԴՀԱՆՈՒՐ ՏԵՂԵԿՈՒԹՅՈՒՆՆԵՐ ԿՈՐՈԶԻԱՅԻ ՄԱՍԻՆ 1.1. Կոռոզիոն պրոցեսների թերմոդինամիկա և կինետիկա Կոռոզիայի առաջնային պատճառը մետաղների թերմոդինամիկական անկայունությունն է տարբեր միջավայրերում տվյալ արտաքին պայմաններում: Կոռոզիայի գործընթացի ինքնաբուխ առաջացման հիմնարար հնարավորությունը որոշվում է թերմոդինամիկայի օրենքներով: Ցանկացած ինքնաբուխ գործընթացի առաջացումը ուղեկցվում է ազատ էներգիայի նվազմամբ։ Կոռոզիոն պրոցեսների ինքնաբուխ առաջացման հնարավորությունը կարելի է գնահատել ΔG1 իզոբարային-իզոթերմալ պոտենցիալի փոփոխությամբ: Մետաղների օքսիդացման ինքնաբուխ պրոցես՝ կոռոզիա, հնարավոր է, եթե ∆G< 0, то есть знак ―минус‖ означает, что изобарно−изотермический потенциал убывает и свободная энергия системы уменьшается. Наоборот, если ∆G > 0, ապա իզոբար-իզոթերմային պոտենցիալի գումարած նշանը համապատասխանում է ազատ էներգիայի ավելացմանը, ինչը ցույց է տալիս այս ռեակցիայի ինքնաբուխ առաջացման անհնարինությունը: ԻԶՈԲԱՐԻԿ-ԻԶՈԹԵՐՄԱՅԻՆ ՊՈՏԵՆՑԻԱԼ (ΔG) – Գիբսի էներգիա, թերմոդինամիկական պոտենցիալներից մեկը, հավասար ΔG = ΔН - TΔS, որտեղ ΔН, ΔS, Т - էնթալպիա, էնտրոպիա, համակարգի թերմոդինամիկական ջերմաստիճան։ ΔG-ն համամասնական է համակարգի մասնիկների թվին: Նշվում է որպես մեկ մասնիկ, այն կոչվում է քիմիական ներուժ: ΔG-ն հարմար է այն գործընթացները նկարագրելու համար, որոնցում հնարավոր է փոխանակում նյութի և շրջակա մարմինների միջև։ Իզոթերմային հավասարակշռության գործընթացում, որը տեղի է ունենում մշտական ճնշման տակ, սա համակարգի ընդհանուր աշխատանքն է՝ հանած արտաքին ճնշման ուժերի դեմ աշխատանքը: Այն հավասար է իզոբար-իզոթերմային պոտենցիալի նվազմանը (այսինքն՝ առավելագույն օգտակար աշխատանք): 1 4 Այնուամենայնիվ, չնայած թերմոդինամիկան հնարավորություն է տալիս որոշել, թե ուսումնասիրվող համակարգը որքան հեռու է հավասարակշռության վիճակից և ունակ է ինքնաբուխ ռեակցիայի, դա չի ցույց տալիս այս գործընթացի արագությունը: Կոռոզիայի արագությունը որոշվում է նրա կինետիկայով: Կոռոզիոն պրոցեսների առանձնահատկությունը նրանց տարասեռ բնույթն է: Դա պայմանավորված է նրանով, որ մետաղի ոչնչացումը տեղի է ունենում երկու փուլերի միջերեսում, որոնք ունեն ագրեգացման տարբեր վիճակներ, օրինակ, մետաղ-հեղուկ, մետաղ-գազի միջերեսում: Նման պայմաններում քիմիական փոխազդեցության կինետիկայի որոշիչ գործոնը կա՛մ քիմիական փոխազդեցության արագությունն է, կա՛մ ռեագենտների մատակարարումը շփման փուլերի ծավալներից դեպի այն միջերեսը, որտեղ տեղի է ունենում կոռոզիոն փոխազդեցություն, և ռեակցիայի արտադրանքի հեռացումը հակառակը: ուղղությունը։ Առաջին դեպքում կոռոզիայի արագությունը որոշվում է կինետիկ հսկողությամբ, երկրորդում՝ դիֆուզիոն հսկողությամբ։ Որոշ դեպքերում կոռոզիայի արագությունը որոշվում է խառը դիֆուզիոն-կինետիկ հսկողության միջոցով: Հաստատուն պրոցեսի դեպքում քիմիական ռեակցիայի արագությունը և դիֆուզիայի արագությունը հավասար են: Կոռոզիայի գործընթացը բաղկացած է մի քանի փուլից, որոնք կարող են առաջանալ կամ հաջորդաբար կամ զուգահեռաբար: Մի քանի հաջորդական փուլերից բաղկացած կոռոզիայի գործընթացի կայուն վիճակի ընդհանուր արագությունը որոշվում է ամենադանդաղ փուլի արագությամբ: Երբ գործընթացի առանձին փուլերը տեղի են ունենում զուգահեռաբար, կոռոզիայի ընդհանուր արագությունը որոշվում է ամենաարագ փուլով: Հետևաբար, եթե փուլերից մեկն ընթանում է շատ ավելի արագ, քան մյուսը, ապա երկրորդ փուլը կարող է անտեսվել: 1.2. Կոռոզիոն պրոցեսների դասակարգումն ըստ առաջացման մեխանիզմի Անկախ կոռոզիոն պրոցեսների առաջացման պայմանների հսկայական բազմազանությունից, դրանք կարելի է դասակարգել ըստ երկու հիմնական բնութագրերի. . Տարբերում են ՔԻՄԻԱԿԱՆ և ԷԼԵԿՏՐԱՔԻՄԻԱԿԱՆ կոռոզիան։ 5-ը տեղի է ունենում չոր գազերում (գազի կոռոզիա) և հեղուկ ոչ էլեկտրոլիտներում2 (կոռոզիա ոչ էլեկտրոլիտներում): Եթե միջավայրը էլեկտրոլիտ չէ (չոր գազեր կամ հեղուկ ոչ էլեկտրոլիտներ), ապա էլեկտրոնների փոխանակումը տեղի է ունենում անմիջապես վերականգնող մետաղի (կարմիր) և ցանկացած նյութի միջև, որը պարունակում է էլեկտրաբացասական տարր, որը կարող է էլեկտրոններ ներգրավել դեպի իրեն՝ օքսիդացնող նյութը Օրինակ՝ Fe + Сl2 → FeCl2 (1) ՔԻՄԻԱԿԱՆ ԿՈՐՈԶԻԱ կարմիր Էլեկտրոնների փոխանցման մնացորդը ox Feº − 2ē → Fe2+ 1 Сl2º + 2ē → 2Cl− Feº + 2Сlº = Fe2+ + 2Cl− ԿՈՌՈԶԻՈՆԱԿԱՆ պրոցեսի փոխազդեցությունը. մետաղը քայքայիչ միջավայրով (էլեկտրոլիտային լուծույթ), որի դեպքում մետաղի ատոմների իոնացումը և քայքայիչ միջավայրի օքսիդացնող բաղադրիչի նվազումը մեկ գործողությամբ չեն կատարվում, և դրանց արագությունը կախված է էլեկտրոդի ներուժից: Էլեկտրաքիմիական կոռոզիայի գործընթացի տարբերակիչ առանձնահատկություններն են. – երկու առանձին պրոցեսների միաժամանակյա առաջացում՝ օքսիդատիվ (մետաղի լուծարում) և վերականգնում (ջրածնի էվոլյուցիա, թթվածնի նվազեցում, մետաղի լուծույթից ազատում և այլն); – մետաղի տարրալուծման պրոցեսն ուղեկցվում է մետաղի մեջ էլեկտրոնների և էլեկտրոլիտում իոնների ուղղորդված շարժումով, այսինքն. էլեկտրական հոսանքի առաջացում; – կոռոզիոն արտադրանքները ձևավորվում են երկրորդական ռեակցիաների արդյունքում: Էլեկտրաքիմիական կոռոզիայի ժամանակ տեղի ունեցող ռեդոքս գործընթացները կարող են ներկայացվել հետևյալ ռեակցիաների տեսքով. որտեղ R(ox)-ը օքսիդացնող նյութ է. ՈՉ ԷԼԵԿՏՐՈԼԻՏՆԵՐԸ այն նյութերն են, որոնց ջրային լուծույթները և հալվածքները չեն փոխանցում էլեկտրական հոսանք։ Դրանք պարունակում են կովալենտային ոչ բևեռային կամ ցածր բևեռային կապեր, որոնք չեն քայքայվում իոնների։ Գազերը, պինդ նյութերը (ոչ մետաղներ) և օրգանական միացությունները (սախարոզա, բենզին, սպիրտ) էլեկտրական հոսանք չեն փոխանցում։ 2 6 R n−(կարմիր) – օքսիդացնող նյութի կրճատված ձև; nē - փոխանցված էլեկտրոնների թիվը: Էլեկտրաքիմիական կոռոզիայի օրինակ է երկաթի օքսիդացման (ժանգոտման) գործընթացը ջրի ազդեցության տակ՝ Fe − 2ē → Fe2+ (անոդային պրոցես՝ երկաթի տարրալուծում) H2O + ½О2 +2ē → 2OH– (կաթոդային պրոցես՝ թթվածնի նվազեցում) −−−−−− −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−. − Fe 2+ + 2OH – → Fe(OH)2 (կոռոզիոն արտադրանքի առաջացում) (2) և (3) ռեակցիաները շարունակվում են խճճված, բայց ենթարկվում են իրենց իսկ կինետիկ օրենքներին։ Այս դեպքում անհրաժեշտ է պահպանել գործընթացի կայունության պայմանները, այսինքն. մետաղների օքսիդացման և օքսիդացնող նյութի նվազեցման արագությունների հավասարությունը: Այս ռեակցիաները կարող են աշխարհագրորեն բաժանվել և տեղի ունենալ մակերեսի տարբեր մասերում: Ստացիոնարության պայմաններից հետևում է, որ բավական է դանդաղեցնել կոնյուգացիոն ռեակցիաներից մեկը, որպեսզի ամբողջ գործընթացի արագությունը նվազի։ 1.3. Կոռոզիոն պրոցեսների դասակարգումն ըստ կոռոզիոն քայքայման բնույթի Ելնելով մետաղի կոռոզիոն քայքայման բնույթից՝ առանձնանում են ԸՆԴՀԱՆՈՒՐ ԵՎ ՏԵՂԱԿԱՆ ԿՈՐՈԶԻԱՆ։ ԸՆԴՀԱՆՈՒՐ ԿՈՐՈԶԻԱՆ տարածվում է մետաղի ողջ մակերեսի վրա այն կարող է լինել միատարր կամ անհարթ (նկ. 1. - 1.2). 1 2 4 5 7 8 3 6 9 Նկ. 1. Կոռոզիայից վնասի տեսակները Կոռոզիայի շատ դեպքեր ներառում են ընդհանուր կոռոզիան, օրինակ, երբ մետաղի էլեկտրոլիտների ազդեցության հետևանքով կոռոզիայից արտադրանքները չեն մնում մետաղի մակերեսին: Այսպիսով, ինտենսիվ ընդհանուր կոռոզիա է նկատվում պղնձի ազոտաթթվի, 7 երկաթի հետ աղաթթվի, ալյումինի հետ կաուստիկ ալկալիների, ցինկի հետ ծծմբաթթվի և այլն փոխազդեցության ժամանակ: Ընդհանուր ընդհանուր կոռոզիան կոռոզիայի ամենաքիչ վտանգավոր տեսակներից է, պայմանով, որ կոռոզիայից վնասվածքի հետևանքով մետաղի լուծարման արագությունը չի գերազանցում ապարատի, սարքի և այլնի շահագործման պահանջներով որոշված ստանդարտները: Եթե մետաղը բավականաչափ հաստ է, ապա կոռոզիան փոքր ազդեցություն ունի կառուցվածքի մեխանիկական ամրությունը նվազեցնելու վրա՝ խաչաձեւ հատվածի վրա համաչափ բաշխված լարումների դեպքում (լարում, սեղմում): Այնուամենայնիվ, ընդհանուր կոռոզիան կարող է վտանգավոր լինել, երբ մասերը ենթարկվում են ճկման և ոլորման, քանի որ այս դեպքում ոչնչացվում են առավել բեռնված շերտերը: ՏԵՂԱԿԱՆ ԿՈՐՈԶԻԱ - առաջացնում է մետաղի մակերեսի միայն որոշ հատվածների ոչնչացում, իսկ մնացածը չի ենթարկվում ոչնչացման կամ ոչնչացման արագությունը շատ ցածր է: Տեղական կոռոզիայի դրսևորումները շատ բազմազան են և կարող են ունենալ տարբեր աստիճանի անհավասարություն, և, հետևաբար, տեղային կոռոզիան բաժանվում է ԿՈՌՈԶԻՈՆԻ ԲԵՏԵՐՈՎ, ԽՈՍՆԵՐԻ, ԿԱԹԱՍՆԵՐԻ (ՓԻՏՈՒՄ), ԸՆՏՐԱԿԱՆ ԿՈՐՈԶԻՈՆԻ, ԿՈՐՈԶԻՈՆԻ, ԿՈՐՈԶԻՎ ՃՏՔԵՐԻՑ: ՄԻՋԲՐԻՍՏԱԼԻՏ Կոռոզիա բծերով, խոցերով, կետերով. տեղային կոռոզիայի տեսակները տարբերվում են ավերված տարածքի տրամագծի և դրա խորության հարաբերակցությամբ (նկ. 1., 4–6): Կետային կոռոզիայի դեպքում ավերված տարածքի տրամագիծը շատ ավելի մեծ է, քան դրա խորությունը, խոցային ոչնչացման դեպքում ավերված տարածքի տրամագիծը համարժեք է դրա խորությանը, իսկ փոսային կոռոզիայի դեպքում քանդված տարածքի տրամագիծը շատ ավելի քիչ է, քան դրա խորությունը: . Որոշ դեպքերում փոսային կոռոզիան կարող է հանգեցնել ոչնչացման, ինչը հատկապես վտանգավոր է խողովակաշարերի, տանկերի և այլնի համար: Փոսային կոռոզիան բնորոշ է պասիվացման՝ արգելակման (քրոմ, ալյումին, չժանգոտվող պողպատներ և այլն) ընդունակ մետաղների համար։ Մետաղների պասիվ վիճակը կարող է խախտվել մակերեսի որոշ ավելի թույլ հատվածներում, օրինակ՝ պաշտպանիչ թաղանթի ծակոտիներում, միջմետաղային ներդիրների վայրերում (օքսիդներ, խարամներ և այլն)։ ԸՆՏՐՈՂ ԿՈՐՈԶԻԱ – բաժանվում է բաղադրիչ-սելեկտիվ (սելեկտիվ) կամ կառուցվածքային-սելեկտիվ (միջբյուրեղային): 8 ԲԱՂԱԴՐԱԿԱՆ-ԸՆՏՐԱԿԱՆ ԿՈՐՈԶԻԱՅԻ օրինակ է արույրի ցինկացումը: Արույր3-ի ցինկացումը բաղկացած է նրանից, որ ցինկը էլեկտրոլիտի մեջ (սովորաբար չեզոք կամ թեթև թթվային pH արժեքով) անցնում է ավելի ինտենսիվ, քան պղնձը: Արույրի մակերևույթի վրա ձևավորվում է պղնձի չամրացված շերտ, որը նպաստում է էլեկտրաքիմիական կոռոզիայի ավելացմանը (միկրոգալվանական բջիջի տեսք): ԿԱՌՈՒՑՎԱԾՔԱՅԻՆ-ԸՆՏՐԱԿԱՆ կոռոզիայի օրինակ է մոխրագույն չուգունի կոռոզիան: Մոխրագույն չուգունի կառուցվածքային ընտրողական կոռոզիան բաղկացած է ֆերիտի բաղադրիչի գերակշռող ոչնչացումից, որի արդյունքում ձևավորվում է գրաֆիտի կմախք, որը լցված է կոռոզիայից արտադրանքով (նկ. 1−3): Միաժամանակ չուգունի մեխանիկական ուժը կտրուկ նվազում է։ ՄԻՋԲյուրեղային Կոռոզիան բնութագրվում է մետաղի ընտրովի ոչնչացմամբ հացահատիկի սահմաններով (նկ. 1–7): Արդյունքում զանգվածի և արտաքին տեսքի փոքր փոփոխության դեպքում կարող է առաջանալ մետաղի ամրության հատկությունների շատ զգալի կորուստ (նկ. 2): 40 Նկ. 2. Մետաղի ամրության հատկությունների կորուստ տարբեր տեսակի կոռոզիոն ոչնչացման ժամանակ 1 – միատեսակ կոռոզիա; 2 – միջհատիկավոր կոռոզիա 20 w-ի կորուստ, % 60 2 0 1 2 4 Քաշի կորուստ, կգ/սմ2 Ծայրահեղ դեպքերում, միջհատիկավոր կոռոզիայի հետևանքով հացահատիկի սահմանների ամբողջական ոչնչացման դեպքում, համաձուլվածքը կարող է փոշու վերածվել: ԿՈՌՈԶԻՈՆ CRACKING-ը տեղային կոռոզիայի դեպք է, որի ժամանակ քայքայումը տեղի է ունենում առաձգական ամենամեծ լարմանը ուղղահայաց ուղղությամբ (նկ. 1 - 8): 3 Արույր – պղինձ-ցինկ համաձուլվածք: 9 Բնորոշ է, որ այս դեպքում կոռոզիոն ճաքը կարող է տարածվել հացահատիկի սահմաններով կամ կտրել բյուրեղյա մարմինը: Կոռոզիայից հոգնածության հետևանքով ոչնչացումը (քայքայիչ միջավայրի և փոփոխական կամ ցիկլային բեռների միաժամանակյա ներգործությամբ) տեղի է ունենում նույն ձևով, ինչպես կոռոզիոն ճաքերի ժամանակ: ԸՆԹԵՐԹԵՎԱՅԻՆ ԿՈՐՈԶԻԱՆ, սկսած մակերևույթից, տարածվում է հիմնականում մակերեսի տակ, ինչը հաճախ հանգեցնում է մետաղի շերտազատման և ուռչման (նկ. 1− 9), օրինակ՝ փորագրման ընթացքում ցածրորակ թիթեղի վրա փուչիկների առաջացում։ կամ կոռոզիայից անոթների և ապարատի շահագործման ընթացքում: 1.4. Կոռոզիայի ցուցիչներ Կոռոզիայի արագությունը քանակականացնելու համար օգտագործվում են կոռոզիայի ցուցիչներ՝ ՄԱՍՈՄԵՏՐԱԿԱՆ, ԾԱՎԱՌԱԿԱՆ, ԽՈՐԱԿԱՆ, ՄԵԽԱՆԻԿԱԿԱՆ, ԸՆԹԱՑԻԿ: 2 ՄԱՍՈՄԵՏՐԱԿԱՆ կոռոզիայի ինդեքսը (կմ, գ/մ ∙ժ) մետաղի զանգվածի փոփոխությունն է՝ կոռոզիայի հետևանքով նմուշի միավորի մակերեսի (ների) և մեկ միավոր ժամանակի վրա: Նմուշի զանգվածի փոփոխությունը սովորաբար որոշվում է որպես փորձարկումից առաջ նմուշի զանգվածի (mо) և փորձարկումից հետո դրա զանգվածի (m1) տարբերությունը ժամանակի ընթացքում (τ) կոռոզիայից արտադրանքի հեռացմամբ (մետաղական զանգվածի կորուստ) . K m = (m0 − m1)/s ∙ τ . (4) 3 2 ԾԱՎԱՌԱԿԱՆ Կոռոզիայի ինդեքսը (Kν, սմ / մ h) կոռոզիայի ընթացքում կլանված կամ արտանետվող գազի ծավալն է (Vo)՝ մետաղի մակերեսի միավորի և ժամանակի մեկ միավորի համար K m = V0 /s ∙ τ: (5) DEPTH կոռոզիայի ինդեքսը (P, մմ/տարի) հաշվի է առնում կոռոզիայի հետևանքով մետաղի հաստության նվազումը՝ արտահայտված գծային միավորներով և ժամանակի մեկ միավորով։ Այս ցուցանիշը օգտակար է տարբեր խտությամբ մետաղների կոռոզիան համեմատելիս։ Անցումը մասոմետրիկ ցուցանիշից դեպի խորություն կարելի է կատարել միատեսակ կոռոզիայի դեպքում՝ օգտագործելով P = K m ∙ 8,76 /γ, (6) բանաձևը, որտեղ γ-ը մետաղի խտությունն է։ ՄԵԽԱՆԻԿԱԿԱՆ կոռոզիայի ցուցանիշը որոշվում է մետաղի մեխանիկական հատկությունների հիմնական ցուցիչներից մեկի փոփոխությամբ կոռոզիայի գործընթացի որոշակի ժամանակահատվածում և արտահայտվում է հարաբերական միավորներով կամ տոկոսով: Եթե առաձգական ուժը օգտագործվում է որպես մեխանիկական ցուցիչ, ապա ուժի ցուցիչի փոփոխությունը (Kσ) որոշվում է Kσ = Δσb/σb բանաձևով, (7), որտեղ σb-ն առաձգական ուժն է մինչև կոռոզիան, Δσb-ը՝ կոռոզիայից հետո մետաղի առաձգական ուժի փոփոխություն τ ժամանակի ընթացքում: Ընթացիկ կոռոզիայի ցուցիչը թույլ է տալիս, օգտագործելով Ֆարադեյի բանաձևը, հաշվարկել կոռոզիայից մետաղի քանակը՝ հիմնվելով կոռոզիայից հոսանքի մեծության վրա Km = IA /nF, (8), որտեղ Km-ը կոռոզիայի արագությունն է՝ հիմնված փոփոխության վրա: մետաղական զանգվածում; I - ընթացիկ ուժ; F – Ֆարադայի հաստատուն; n - մետաղական վալենտություն; A-ն մետաղի ատոմային զանգվածն է։ Մետաղների կոռոզիոն դիմադրությունը որակապես և քանակապես գնահատելիս խորհուրդ է տրվում օգտագործել տասը բալանոց սանդղակ4: Հարկ է նշել, որ չնայած մետաղների կոռոզիոն դիմադրության գնահատման այս սանդղակը դարձել է ավելի լայն տարածում, հատկապես քիմիական արդյունաբերության մեջ, այն համընդհանուր չէ, քանի որ տարբեր նպատակներով սարքավորումների համար թույլատրելի կոռոզիայի տեմպերը կարող են տարբերվել մեծության կամ կարգով: ավելին։ Աղյուսակ 1. Մետաղների և համաձուլվածքների կոռոզիոն դիմադրության բալիկ սանդղակը լիովին կայուն, շատ կայուն, ցածր դիմացկուն անկայուն կոռոզիայից արագություն, մմ/տարի ավելի քիչ, քան 0,001-ից մինչև 0,005-ից 0,01-ից 0,05-ից 0,05-ից ավելի: 0,1-ից 0,1-ից 0,5-ից 0,5-ից 1,0-ից 1,0-ից 5,0-ից 5,0-ից 10,0-ից 10,0-ից ԳԱԼԻՍ 1 2 3 4 5 6 7 8 9 10 Կոռոզիայից և ծերացման դեմ պաշտպանության միասնական համակարգ: Ստորգետնյա կառույցներ. Կոռոզիայից պաշտպանության ընդհանուր պահանջներ. ԳՕՍՏ 9.602−2005, http://www.gosthelp.ru/gost/gost206.html 4 11 Գլուխ 2. ՄԵՏԱՂՆԵՐԻ ՔԻՄԻԱԿԱՆ ԿՈՐՈԶԻԱ Մետաղների քիմիական կոռոզիան արտաքին միջավայրի հետ քիմիական փոխազդեցության հետեւանքով դրանց ոչնչացման ինքնաբուխ գործընթաց է: Քիմիական կոռոզիայի գործընթացի տարբերակիչ առանձնահատկությունները հետևյալն են. - էլեկտրական հոսանքի բացակայություն; - կոռոզիայից արտադրանքի ձևավորում անմիջապես այն մակերեսի վրա, որտեղ տեղի է ունենում դրա ոչնչացումը: ՔԻՄԻԱԿԱՆ ԿՈՐՈԶԻԱՆ հեղուկ (l) կամ գազային փուլի (g) փոխազդեցության տարասեռ ռեակցիա է պինդ փուլի (ներ) - մետաղի հետ և բաժանվում է 2 տեսակի (գազի կոռոզիա, կոռոզիա հեղուկ ոչ էլեկտրոլիտներում): 2.1. Գազի կոռոզիա Գործնականում ամենակարևորը ԳԱԶԻ ԿՈՐՈԶԻԱՆ է: Ամենից հաճախ այն դրսևորվում է որպես մետաղական նյութերի կոռոզիա բարձր ջերմաստիճաններում (տասնյակ անգամ ավելի բարձր, քան ջրի եռման կետը) թթվածին պարունակող գազերի մթնոլորտում: Այդ իսկ պատճառով այն կոչվում է ԲԱՐՁՐ Ջերմաստիճանի ԿՈՐՈԶԻԱ կամ ԲԱՐՁՐ ՋԵՐՄԱՑՆՈՂ ՕՔՍԻԴԱՑՈՒՄ։ Մետաղներից և համաձուլվածքներից պատրաստված արտադրանքի մակերեսին նման քայքայիչ միջավայրի հետ դրանց փոխազդեցության արդյունքում ձևավորվում է տարբեր մետաղական օքսիդներ ներկայացնող արտադրանքի թաղանթ։ Միևնույն ժամանակ, կախված աշխատանքային պայմաններից, կարող են առաջանալ այլ միացություններ, օրինակ՝ ծծմբային մետաղներ5։ Օրինակ, նավթավերամշակման արդյունաբերությունում գազի կոռոզիան ազդում է, օրինակ, վառարանների խողովակների, ռեակտորի պատերի, ռեակցիայի սյուների և այլ սարքավորումների վրա, որոնք ենթարկվում են ջրածնի սուլֆիդի, ածխածնի երկօքսիդի, ազոտի, թթվածնի և բարձր ջերմաստիճանի այլ գազերի: «Գազային կոռոզիա» տերմինը վերաբերում է մետաղների ոչնչացմանը, որը առաջանում է բարձր ջերմաստիճաններում գոլորշիների և գազերի ազդեցությամբ, թեև այն կարող է կիրառվել նաև ավելի ցածր ջերմաստիճանների դեպքում՝ 5 Ծծմբի ՄԵՏԱՂՆԵՐ, նույնը, ինչ սուլֆիդները: 12 ապահովել, որ հեղուկի թաղանթը, որը փոխանցում է էլեկտրական հոսանք, չի խտանում մետաղի վրա: Մետաղներից և համաձուլվածքներից պատրաստված արտադրանքի մակերեսին քայքայիչ միջավայրի հետ դրանց փոխազդեցության արդյունքում ձևավորվում է տարբեր մետաղական միացություններ ներկայացնող արտադրանքի թաղանթ։ Ընդհանուր առմամբ քիմիական կոռոզիայի պրոցեսը կարելի է նկարագրել, օրինակ, մետաղի օքսիդացման ռեակցիայով տաքացվող (T >>373K) գազով (G2)՝ 2Ме + nГ2 → 2Men+Гn։ Թթվածնային միջավայրում նման գործընթացը կարելի է նկարագրել հետևյալ Me(T) + ½ O2 ↔ MeO(T) հավասարմամբ։ Այս ռեակցիան հավասարակշռված է բարձր ջերմաստիճաններում: Հակառակ գործընթացը կոչվում է ՕՔՍԻԴԻ ԴԻՍՈՑԻԱՑՈՒՄ: Գազային միջավայրում առկա թթվածինը բնութագրվում է մասնակի ճնշմամբ (pO2): Մետաղների օքսիդացման քիմիական ռեակցիան հավասարակշռության մեջ կլինի օքսիդի դիսոցման ռեակցիայի հետ, եթե թթվածնի մասնակի ճնշումը (pO2) և ՕՔՍԻԴԻ ԴԻՍՈՑԻԱՑՄԱՆ ԱՌԱՁԳՈՒԹՅԱՆ (pMeO)7 հավասարվեն (pMeO = pO2) 1. Երբ pO2 > pMeO, ռեակցիան շարունակվում է։ հիմնականում օքսիդի առաջացման ուղղությամբ։ Երբ pMeO > pO2 ռեակցիան ընթանում է հիմնականում հակառակ ուղղությամբ: Մետաղների օքսիդացումը բազմաստիճան տարասեռ գործընթաց է, որի պատճառով մակերեսի վրա առաջանում է սկզբում մոնո-, ապա բազմամոլեկուլային օքսիդի շերտ, այսպես կոչված, օքսիդ թաղանթ։ Նրա հաստության աճը կարող է առաջանալ կամ միաժամանակ երկու ուղղություններով (մետաղական և գազային միջավայր), կամ գերակշռող մեկում (նկ. 3): ՄԱՍՆԱԿԻ ՃՆՇՈՒՄ (ուշ լատիներեն partialis – մասնակի), ճնշումը, որը կունենա գազային խառնուրդի մեջ ընդգրկված գազը, եթե այն նույն ջերմաստիճանում զբաղեցներ խառնուրդի ծավալին հավասար ծավալ։ 7 ՕՔՍԻԴՆԵՐԻ առաջացման կամ ՋԵՐՄԱԿԱՆ ԴԻՍՈՑԻԱՑՄԱՆ ռեակցիաների համար թթվածնի հավասարակշռության մասնակի ճնշումը կոչվում է ՕՔՍԻԴԻ ԴԻՍՈՑԻԱՑՄԱՆ ԱՐԿՈՒՑՈՒԹՅՈՒՆ։ Դրա արժեքը կապված է ռեակցիայի հավասարակշռության հաստատունի հետ և, հետևաբար, ջերմաստիճանի ֆունկցիա է։ 6 13 ա բ գ Նկ. Նկ.3. Մետաղական մասի մակերեսի վրա օքսիդային թաղանթի առաջացման և աճի իոն-էլեկտրոնային մեխանիզմի սխեման Եթե աճը տեղի է ունենում գազային միջավայրի ուղղությամբ, ապա նկատվում է մասի չափսերի զգալի աճ , օրինակ՝ օքսիդացման ժամանակ, որը պետք է հաշվի առնել մեքենաշինության մեջ։ Աճման ուղղությունը որոշվում է օքսիդ թաղանթի ներսում մետաղական իոնների Մen+ և O2− հակադիֆուզիայի արագությունների հարաբերակցությամբ: Եթե մետաղական իոնների (rdif.Me) և թթվածնի (rdif.O2) դիֆուզիոն արագությունները մեծապես տարբերվում են, ապա օքսիդի թաղանթի աճը հիմնականում տեղի է ունենում մեկ ուղղությամբ, օրինակ, rdiff.O2-ով:< rдиф.Mе − в направлении газовой среды и наоборот (рис. 3, в, б). В большинстве случаев, скорости диффузии ионов металла и кислорода соизмеримы, но для ионов кислорода скорость несколько ниже из−за того, что они больше по размерам, поэтому зона роста, находящаяся в толще самой оксидной пленки, располагается ближе к ее внешней поверхности (рис. 3, а). По мере утолщения оксидной пленки процессы встречной диффузии ионов и электронов затрудняются. С повышением температуры упругость диссоциации оксидов возрастает у всех металлов. Поэтому, начиная от какой−то температуры, когда упругость диссоциации оксида металла становится больше парциального давления кислорода в воздухе (при атмосферном давлении рО2 = 0,21 ат), металл перестает окисляться и становится вполне малоактивным по отношению к кислороду. Так, например, серебро при температуре 300 ºК термодинамически еще не устойчиво, а при 400 ºК и при всех более высоких температурах упругость диссоциации Ag2O превышает парциаль14 ное давление кислорода в воздухе. При температуре 2000 ºК медь тоже становится неокисляемым металлом, однако для таких металлов, как Fе, Zn, Ni и др., даже при этих температурах упругость диссоциации окислов остается еще достаточно низкой и, следовательно, протекание реакции окисления вероятно. Необходимо учесть, что температурная зависимость для кинетики процесса окисления совершенно иная, чем для термодинамической вероятности окисления. Поэтому нет никакого противоречия в том, что термодинамическая вероятность окисления металла с повышением температуры падает, а реальная скорость окисления (при условии, что термодинамически этот процесс остается еще возможным) с повышением температуры возрастает. 2.2. Образование тонких пленок на металлах Ранее было отмечено, что в большинстве случаев образовавшиеся продукты газовой коррозии – оксиды металла остаются на поверхности металла в виде пленки. Эти пленки определяют кинетику процесса и в случае наличия защитных свойств могут привести к замедлению коррозии. Чтобы пленка оксида металла обладала защитными свойствами, она должна быть: − сплошной; − прочно сцепляться с основным металлом и обладать близким к нему коэффициентом теплового расширения; − быть химически инертной по отношению к данной агрессивной среде; − обладать твердостью и износостойкостью. Даже при обычной температуре на поверхности многих металлов и сплавов на воздухе образуются слои оксидов. Еще в 1836 г. М. Фарадей высказал предположение, что даже на блестящей поверхности металлов существует тончайшая, невидимая защитная (оксидная) пленка. Этим он объяснял пассивность железа в азотной кислоте. Если пленка пористая, рыхлая и характеризуется плохим сцеплением с основным металлом, то даже при условии инертности в данной агрессивной среде, она не будет обладать защитными свойствами. Пленки по толщине (δ) делятся на три группы: − тонкие (невидимые), δ < 4000 нм; − средние (дающие цвета побежалости), δ = от 4000 до 50000 нм; 15 − толстые (видимые), δ > 50000 նմ. Չոր օդի հետ մետաղի փոխազդեցության ժամանակ առաջացած թաղանթների հաստությունը տարբեր է և կախված է մետաղի տեսակից, ջերմաստիճանից և այլ գործոններից։ Այսպիսով, պղնձի և երկաթի վրա թաղանթների հաստությունը սենյակային ջերմաստիճանում 100–300 նմ է, իսկ ալյումինի վրա՝ 1000–1500 նմ։ Եկեք մի քանի օրինակ բերենք, որոնք ապացուցում են մետաղների վրա բարակ թաղանթների առկայությունը։ 1. Երբ երկաթե ափսեի մաքուր փայլուն մակերեսը մի ծայրով տաքացվի, դրա վրա կհայտնվեն ինտերֆերենտային գույներ՝ «գույներ արատավորել»: Սա ցույց է տալիս տարբեր հաստության օքսիդների տեսքը: Գույներն անցնում են հետևյալ հաջորդականությամբ՝ ափսեի սառը ծայրից համապատասխանաբար տաքը՝ դեղին, նարնջագույն, կարմիր, մանուշակագույն, մանուշակագույն, կապույտ։ Ձևավորված թաղանթի պաշտպանիչ հատկությունները պղնձի նիտրատի լուծույթի կաթիլների միջոցով ստուգելիս, այն վայրերում, որտեղ թաղանթը թույլ պաշտպանիչ հատկություններ ունի, այն փոխազդում է երկաթի հետ՝ Cu(NO3)2 + Fe → Fe(NO3)2 + Cu: Արդյունքում կաթիլների տակ մակերեսին կհայտնվի պղինձ։ Այն պահին, երբ ռեակցիան տեղի կունենա, կարելի է դատել տարբեր հատվածներում թաղանթների պաշտպանիչ հատկությունների մասին: Այս փորձի ժամանակ լավագույն պաշտպանիչ հատկությունները հայտնաբերվել են այն տարածքում, որը գտնվում է ջեռուցման վայրից հեռու (դեղին գոտու հետևում), որտեղ մակերեսը մնում է անփոփոխ: Ակնհայտ է, որ այս հատվածում կա շատ բարակ, բայց ավելի խիտ թաղանթ՝ համեմատած ջեռուցվող տարածքների հետ։ 2. Եթե սնդիկի տակ ասեղը (կամ ածելիի սայրը) կոտրեք, կոտրված կետերում ամալգամ կառաջանա: Երբ կոտրված նմուշները տեղադրվում են օդում սնդիկի մեջ, միաձուլում չի նկատվում։ Դա բացատրվում է շատ բարակ օքսիդ թաղանթի ձևավորմամբ, որը կանխում է միաձուլումը։ 3. Երբ երկաթը տեղադրվում է կալիումի հիդրօքսիդի լուծույթի մեջ՝ յոդի ավելցուկով, լուծույթի երկաթի մակերեսին խորը քերծվածք է առաջանում։ Որոշ ժամանակ անց քերծվածքի տեղում երկաթը սկսում է լուծարվել, իսկ ապակու ներքևում մնում են փաթիլներ, որոնք հետագա ուսումնասիրությունից հետո պարզվում է, որ երկաթի (III) օքսիդ է: Մետաղի վրա թաղանթի ձևավորման գործընթացը տեղի է ունենում փուլերով. 16 Քայքայիչ միջավայրի հետ մետաղի փոխազդեցության գործընթացի առաջին փուլը մետաղի մակերեսի վրա օքսիդացնող նյութի (O2, CO2, H2O, SO2) քիմիզորբումն է, օրինակ՝ Me(sol) + (O2) = Me( սոլ) + 2Օադս. Մետաղի և օքսիդացնող նյութի միջև քիմիական մերձեցման առկայության դեպքում իրականացվում է մետաղի փոխազդեցության երկրորդ փուլը քայքայիչ միջավայրի հետ՝ քիմիզորբացված թաղանթի անցումը օքսիդի։ Այս գործընթացը կարող է պայմանականորեն նկարագրվել xMe(s) + yOads = MexOy ձևի ռեակցիայով: Մետաղի մակերևույթի վրա ձևավորված օքսիդի թաղանթը կարող է դանդաղեցնել կոռոզիայի գործընթացը՝ օքսիդացնող նյութի մատակարարումը օքսիդացնող մետաղի մակերեսին արգելակելու պատճառով: Այս դեպքում ֆիլմն ՈՒՆԻ ՊԱՇՏՊԱՆԻՉ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐ. 2.2.1. Մետաղների վրա թաղանթների շարունակականության պայման Միայն ՇԱՐՈՒՆԱԿԱԿԱՆ ՖԻԼՄԵՐԸ կարող են պաշտպանիչ հատկություն ունենալ: Նման ֆիլմի ձևավորման հնարավորությունը որոշվում է Pilling–Bedworth-ի շարունակականության պայմանով: Մետաղական մակերեսի վրա հայտնված միացության մոլային ծավալը (Vok) պետք է ավելի մեծ լինի, քան մետաղի (VMe) ծավալը, որը սպառվում է մի մոլի ձևավորման համար՝ Vok/VMe >1: Եթե Vok/VMe< 1, то пленка не может быть сплошной. К металлам, не удовлетворяющим условию сплошности при окислении их кислородом, относятся щелочные и щелочно−земельные металлы. Сплошность пленок – необходимый, но недостаточный фактор, определяющий ее защитные свойства. Как показал Францевич И. Н., у пленок с Vok/VMe >>1-ը չի կարող ունենալ բարձր պաշտպանիչ հատկություններ՝ դրանցում մեծ ներքին լարումների առաջացման պատճառով (օրինակ՝ MoO3 կամ WO3)։ Ծավալային հարաբերակցության վերին սահմանը վերցված է 2,5։ Այնուհետև զտված շարունակականության պայմանը նման է հետևյալին< Vok/VMe < 2,5. 2.2.2. Законы роста оксидных пленок на металлах Процесс роста ПОРИСТОЙ ПЛЕНКИ не осложняется процессом подвода окислителя к поверхности металла, а контролируется скоростью химической реакции образования оксида. Скорость коррозии в этом случае выражается уравнением: 17 V = dx/d = kC, где x − толщина пленки; – время; k − константа скорости химической реакции образования оксида; C − концентрация окислителя на поверхности метала. Рост пористой пленки, контролируемый скоростью химической реакции окисления металла, протекает во времени ПО ЛИНЕЙНОМУ ЗАКОНУ. Линейный закон роста имеет место: − при высокотемпературном окислении на воздухе и в среде кислорода при Vok/VMe<1; − в случае образовании летучих оксидов. Сплошные пленки затрудняют проникновение реагентов друг к другу и их рост сопровождается самоторможением процесса. Результирующая скорость этого сложного процесса определяется скоростью самой медленной стадии, т.е. возможны различные варианты контроля течения процесса. 1−й вариант. Скорость коррозии контролируется стадией массопереноса (диффузионный контроль процесса). В этом случае концентрация окислителя на границе раздела Ме – оксидная пленка равна нулю, так как скорость химической реакции весьма велика. Уравнение скорости течения коррозии определяется ПАРАБОЛИЧЕСКИМ ЗАКОНОМ роста оксидной пленки. Параболический закон роста реализуется, в частности, при окислении железа на воздухе при различных температурах. 2−ой вариант. В предыдущем случае С = 0, т.е. накопление окислителя на внутренней поверхности оксидной пленки не происходит. Если учесть возможность кинетического торможения процесса роста оксидной пленки наряду с торможением на стадии массопереноса (диффузионно−кинетический контроль процесса), в этом случае приходим к СЛОЖНО − ПАРАБОЛИЧЕСКОМУ ЗАКОНУ роста оксидной пленки. Рост оксидных пленок по сложно−параболическому закону выполняется: а) при окислении железа в парах воды или в атмосфере СО2; б) при окислении Сo, Сu в атмосфере чистого кислорода; в) при частичном разрушении оксидной пленки. Рост оксидных пленок при диффузионно−кинетическом контроле может быть выражен ТАКЖЕ СТЕПЕННЫМ ЗАКОНОМ. 18 3−й вариант. Часто рост пленки протекает медленнее, чем это следует из параболического закона роста. Это наблюдается при возникновении оксидных пленок при низких температурах (на Сu в О2 при t < 100 оС; на Аl, Тi, Ni, Zn в О2 при t = 300400 оС.) Затухание объясняется либо уплотнением пленок, либо появлением дефектов (пузырей, расслоений). В этих случаях рост толщины пленки протекает в соответствии с логарифмическим законом роста: x = ln(K). 2.3. Термодинамика процесса химической коррозии В качестве примера рассмотрим процесс окисления металла в атмосфере кислорода. Процесс окисления металла может быть представлен реакцией вида: 2Ме + nО2 → Me2n+Оn. Движущая сила процесса коррозии (ДСП) может быть определена с помощью термодинамики. Торможение процесса (ТП) не может быть определено термодинамически, однако с помощью термодинамики можно оценить условия, уменьшающие или исключающие протекание процесса (применение защитных сред, катодная защита, обескислороживание и др.). Независимо от механизма коррозии возможность ее протекания определяется знаком изменения термодинамического потенциала (см. раздел 1.1). Любое изменение энергии системы характеризует переход ее в новое состояние и является мерой стабильности системы: ΔG = GII − GI , где ΔG – энергия, израсходованная на изменение состояния системы, например, на процесс коррозии; GI − энергия системы в исходном состоянии, например, металла в конкретных условиях; G II − энергия системы в новом состоянии, например, прокорродировавшего металла. Рассчитать ΔG можно, вспомнив начало химии8. Величину изобарно-изотермического потенциала можно рассчитать по разности между суммами Δ G продуктов реакции и исходных веществ: GХР = ΔG ni – ΔG mi. (прод. р-ции) (исх. в-в). ΔG - является функцией температуры. Стандартные значения для большинства веществ сведены в справочные таблицы термодинамических величин. Изменение энергии Гиббса в зависимости от температуры учитывается уравнением Гиббса. ΔG Т = ΔН 298 – 298 Δ S 298. ΔG простого вещества = 0. Определить энергию Гиббса для любой химической реакции можно по уравнению ΔG = ΔG + RТ ln К, рассчитав предварительно величину константы равновесия, например, по равновесным концентрациям веществ. При равновесии ΔG=0, поэтому ΔG+RТlnК=0, следова8 19 2.4. Кинетика процесса химической коррозии Хотя термодинамика и дает ответ на вопрос о том, насколько изучаемая система отдалена от состояния равновесия, но ответ на весьма важный практический вопрос о скорости протекания коррозионного разрушения в рамках термодинамики получен быть не может. Рассмотрением этого вопроса и занимается кинетика коррозионных процессов. 2.4.1. Скорость процесса коррозии. Показатели химической коррозии СКОРОСТЬ КОРРОЗИОННОГО процесса может быть представлена в общем виде с помощью уравнения: СКОРОСТЬ КОРРОЗИИ (СК) = ДСП / ТП, где ДСП − движущая сила процесса; ТП − торможение процесса. Скорость химической коррозии определяют количественно по наблюдениям во времени за изменением какой−либо подходящей для этих целей величины, изменяющейся в процессе коррозии. Тогда истинная скорость коррозии металлического материала определяется из выражения: V = dy/d, где y − изменяющаяся в процессе коррозии характеристика свойств материала; − время коррозии. Для количественного выражения скорости коррозионных разрушений на практике пользуются показателями коррозии, являющимися, по сути, отражением СРЕДНЕЙ СКОРОСТИ КОРРОЗИОННОГО разрушения материала: Vср=∆y/∆. Показатели коррозии. 1. ГЛУБИННЫЙ ПОКАЗАТЕЛЬ коррозии: Kn=∆П/∆, где ∆П − глубина (средняя или максимальная) коррозионного разрушения; ∆ − промежуток времени коррозии. 2. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ ТОЛЩИНЫ образующейся на металле пленки продуктов коррозии: Kn= ∆h/∆, где ∆h − изменение толщины образующейся на металле пленки продуктов коррозии. тельно, ΔG = – RТlnК. Данное уравнение позволяет также определить значение константы равновесия химической реакции по величине изобарно-изотермического потенциала. Для определения направления протекания многих химических реакций достаточно оценить знак Δ G. 1). При ΔН 0 , Δ S 0 реакция самопроизвольна (Δ G 0) при Т. 2). При ΔН 0, Δ S 0 реакция обратная (Δ G 0) при любой Т. 3). При ΔН 0, Δ S 0, реакция самопроизвольна (Δ G 0) при любой Т. 4). При ΔН 0, ΔS 0 реакция самопроизвольна (Δ G 0) при Т. 20 3. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ МАССЫ Km=∆m/S∆, где ∆m − изменение массы корродирующего металла; S – площадь поверхности коррозии. 4.ОБЪЕМНЫЙ ПОКАЗАТЕЛЬ КОРРОЗИИ Kv=∆V/S∆, где ∆V − объем газа, выделившегося или поглощенного в процессе коррозии и приведенный к нормальным условиям. 5. МЕХАНИЧЕСКИЙ ПОКАЗАТЕЛЬ КОРРОЗИИ Кs=(∆s/∆)100 %, где ∆s − относительное изменение характеристики механического свойства. 6. ПОКАЗАТЕЛЬ ИЗМЕНЕНИЯ ЭЛЕКТРИЧЕСКОГО СОПРОТИВЛЕНИЯ KR=(∆R/∆)100 %, где ∆R − относительное изменение электросопротивления образца. 2.4.2. Влияние внешних факторов на химическую коррозию металлов Скорость и характер процесса химической коррозии металлов зависит от ряда факторов. ВНЕШНИМИ ФАКТОРАМИ называют те, которые связаны с составом коррозионной среды и условиями коррозии (температура, давление, скорость перемещения коррозионной среды и т.д.). Температура − мощный внешний фактор коррозии. Характер влияния температуры на скорость окисления металла определяется зависимостью константы скорости реакции окисления (k) и диффузии (D) от температуры. И k = f(T) и D = f(T) описываются одним и тем же уравнением (уравнение Аррениуса): k = k0 exp (−E/RT), (9) где k0 − константа; Е − энергия активации химической реакции. D = D0 exp (−E1/RT), (10) 1 где D0 – константа; Е − энергия активации диффузии. Таким образом, вне зависимости от вида контролирующей стадии процесса окисления с повышением температуры скорость окисления резко возрастает. Колебания температуры, особенно переменный нагрев и охлаждение, увеличивают скорость окисления металла, так как в защитной пленке образуются трещины. Состав газовой фазы. Влияние состава газовой фазы на скорость коррозии металла велико, специфично и изменяется с изменением температуры. В частности, на скорость окисления железа и 21 стали особенно сильно влияют кислород, соединения серы, водяные пары. Приведенные ниже данные свидетельствуют о зависимости увеличения относительной скорости коррозии стали с 0,17 % углерода от состава газовой фазы при 900 оС: Состав газовой фазы Кислород Чистый воздух Чистый воздух + 2 % SO2 Чистый воздух + 5 % H2O Чистый воздух + 5 % SO2+ 5 % H2O % 200 100 118 134 276 Значительное влияние на коррозию сталей и сплавов оказывают продукты горения топлива, содержащие ванадий (например, V2O5). Это соединение находится в золе от сжигания дешевого топлива − мазута, нефтепродуктов. Зола, налипая на металл, увеличивает скорость его коррозии в десятки раз. Причина этому – «ванадиевая коррозия», обусловленная легкоплавкостью V2O5, и его способностью ОФЛЮСОВЫВАТЬ (переводить в жидкое состояние) химические соединения золы и окалины. Пятиокись ванадия участвует в процессе окисления железа: 4Fe + 3V2O5 = 2Fe2O3 + 3V2O3, V2O3 + O2 = V2O5, V2O5 + Fe2O3 = 2FeVO4. Повышение содержания СО в газовой фазе понижет скорость коррозии углеродистых и низколегированных сталей, но при больших количествах СО в газовой фазе может произойти науглероживание поверхности стали. При этом возможны следующие химические реакции: 2CO + O2 = 2CO2, 2CO = Cсаж + CO2. Давление окислителя. Если бы поверхность металла не была покрыта оксидной пленкой, то скорость окисления была бы пропорциональна парциальному давлению окислителя (для двухатомных газов – PГ2). Так как поверхность металла покрыта слоем оксида, то зависимость скорости окисления от величины парциального давления окисляющего газа определяется строением защитной пленки. В то же время при окислении железа при 700 − 950о С скорость окисления не зависит от парциального давления Po2. 22 Скорость движения газовой фазы. Окисление как гетерогенный процесс определяется скоростью подвода и отвода реагентов в зону реакции. Поэтому, чем больше скорость движения потока газа, тем больше и скорость окисления металла. Режим нагрева металла. Влияние режима нагрева металла может быть рассмотрено в зависимости от влияния колебаний температуры. Иначе говоря, переменные нагрев и охлаждение увеличивают скорость окисления ввиду нарушения сохранности защитной пленки. 2.4.3. Влияние внутренних факторов на химическую коррозию металлов ВНУТРЕННИМИ называют факторы, связанные с составом, структурой, внутренними напряжениями в металле, качеством обработки поверхности металла и др. Состав сплава. Применительно к наиболее важным конструкционным сплавам на основе железа для случая газовой коррозии можно отметить следующее. 1. При высоких температурах (более 800оС) с увеличением содержания углерода в стали скорость ее окисления и обезуглероживания уменьшается вследствие более активного образования СО, что снижает окислительный потенциал газовой фазы. 2. Сера фосфор, никель, марганец практически не влияют на скорость окисления железа. 3.Титан, медь, кобальт, бериллий заметно снижают скорость окисления железа. 4. Хром, алюминий, кремний сильно замедляют окисление железа. 5. Ванадий, вольфрам и молибден могут значительно ускорить окисление стали, которое иногда носит катастрофический характер. Структура сплава. Анализ экспериментальных данных свидетельствует о том, что чем меньше в сплаве структурных составляющих, тем выше его жаростойкость. Применительно к сплавам железо – углерод наиболее устойчивой является АУСТЕНИТНАЯ СТРУКТУРА9. Аустенит (γ-фаза) − высокотемпературная гранецентрированная модификация железа и его сплавов. В углеродистых сталях аустенит − это твѐрдый раствор внедрения, в котором атомы углерода входят внутрь элементарной ячейки γ-железа во время конечной термообработки. В сталях, содержащих другие металлы (кроме железа, легированные стали), атомы металлов замещают атомы железа в кристаллической решетке, и возникает твердый раствор замещения. Фаза названа в честь сэра Уильяма Чандлера Робертс-Остина (англ. William Chandler Roberts-Austen, 1843 − 1902). 9 23 Всего различают пять больших групп нержавеющих сталей, определяемых их микроструктурой. Наиболее распространенными являются три: АУСТЕТНИТНЫЕ (AUSTENITIC) − не магнитная сталь с основными составляющими 15−20 % хрома и 5−15 % никеля, который увеличивает сопротивление коррозии. Она хорошо подвергается тепловой обработке и сварке. Обозначается буквой A в начале наименования марки. Именно аустенитная группа сталей наиболее широко используется в промышленности и в производстве элементов крепежа. МАРТЕНСИТНЫЕ (MARTENSITIC) − значительно более твердые, чем аустетнитные стали и могут быть магнитными. Они упрочняются, закалкой и отпуском подобно простым углеродистым сталям и находят применение главным образом в изготовлении столовых приборов, режущих инструментов и общем машиностроении. Больше подвержены коррозии. Обозначаются буквой С. ФЕРРИТНЫЕ (FERRITIC) стали значительно более мягкие чем мартенситные по причине малого содержания углерода. Они также обладают магнитными свойствами. Обозначаются буквой F. Стали с двухфазной АУСТЕНИТНО−ФЕРРИТНОЙ СТРУКТУРОЙ менее устойчивы против окисления. Их меньшая жаростойкость связывается с большей неоднородностью образующейся защитной пленки, что приводит к ее разрушению при росте (неоднородность возникающих внутренних напряжений). Так хромоникелевые стали с однофазной аустенитной структурой более устойчивы против окисления, чем двухфазные: Х12Н12М2Т, Х12Н9Т ведут себя лучше, чем ОХ21Н5МД2Т или 1Х21Н5Т 2]. На жаростойкость10 чугунов кроме их состава влияет и структура. Существенное влияние оказывает форма графитных включений. Так, при шаровидной форме графита стойкость против окисления выше, чем при пластинчатой. Установлено, что предварительная холодная пластичная деформация несколько ускоряет окисление металла вследствие повышения запаса его энергии. Чем тщательнее обработана поверхность металла, тем меньше скорость его окислеЖаростойкость − окалиностойкость, способность металлических материалов противостоять химическому разрушению поверхности под воздействием воздушной или иных газообразных сред при высоких температурах. 10 24 ния, что обусловлено лучшей сохранностью защитных пленок на гладкой поверхности. 2.5. Некоторые случаи газовой коррозии металлов в технологических средах В химической промышленности многие технологические процессы или их определенные стадии протекают в газовой среде в условиях повышенных температур и давлений (рис.4). При температурах от 100 до 200 − 300 °С многие газы не опасны. Химическая активность газов и скорость газовой коррозии металлов сильно возрастают при температурах выше 200 − 300 °С. Так, Cl2 начинает действовать на железные сплавы при Рис. 4. Некоторые случаи газовой температуре > 200 °C, HCl - > մետաղների կոռոզիա տեխնոլոգիական - 300 °C, SO2, NO2, ծծմբի գոլորշիներում: > 500 °C: Տեխնոլոգիական գազային միջավայրերի վարքագծի այս առանձնահատկությունները և արդյունաբերության մեջ դրանց լայն կիրառումը պահանջում են իրական պայմաններում մետաղների վարքագծի ավելի մանրամասն դիտարկում: 2.5.1. Երկաթի, չուգունի և պողպատի կոռոզիան O2, CO2, H2O գոլորշիների մթնոլորտում Օդի թթվածնի ազդեցությունը երկաթ-ածխածնային համաձուլվածքների վրա հանգեցնում է երկաթի օքսիդացման՝ պողպատի դեկարբուրացման և աճի հետ: չուգունից։ Բարձր ջերմաստիճաններում երկաթի օքսիդացման արդյունքում առաջանում է կոռոզիոն արտադրանքի շերտ, որը կոչվում է SCALE: Կշեռքն ունի բարդ կառուցվածք և ներառում է մի քանի օքսիդներ. Fe2O3 – ՀԵՄԱՏԻՏ ունի ռոմբոեդրալ վանդակավոր; FeO – VUSTIT-ն ունի թերի բյուրեղային ցանցի կառուցվածք: Վուստիտը ձևավորվում է 575 oC-ից բարձր ջերմաստիճանում և քայքայվում դանդաղ սառեցման ժամանակ՝ 4FeO Fe3O4 + Fe։ 25 575 °C-ից ցածր սանդղակի մեջ վուստիտ չկա, և Fe3O4-ի շերտը ուղղակիորեն հարում է պողպատի մակերեսին: Պողպատի օքսիդացման արագությունը (տես բաժին 2.4.1) աճում է ջերմաստիճանի բարձրացման հետ՝ համաձայն էքսպոնենցիալին մոտ օրենքի (նկ. 5), իսկ կոորդինատներում logk − 1/T արտահայտվում է կոտրված գծով, որի յուրաքանչյուր ընդմիջում համապատասխանում է. որոշ վերափոխում. Այսպիսով, 575 ºC ջերմաստիճանում սանդղակի մեջ հայտնվում է wustite FeO-ի ենթաշերտ, որը չի խանգարում թթվածնի դիֆուզիային, ինչի արդյունքում մեծանում է գործընթացի ակտիվացման էներգիան և մեծանում մետաղի օքսիդացման արագությունը։ ~ 900 ºС ջերմաստիճանում կորի ընդմիջումը համապատասխանում է պողպատի ալոտրոպային փոխակերպմանը: Պողպատի օքսիդացման արագության ջերմաստիճանային կախվածության փոփոխության բնույթը ցույց է տալիս, որ ավստենիտիկ կառուցվածքը ավելի ջերմակայուն է, որի դեպքում ջերմաստիճանի բարձրացման հետ նկատվում է օքսիդացման արագության ավելի դանդաղ աճ: Պողպատներում և չուգունում օքսիդացման հետ մեկտեղ տեղի է ունենում ածխաթթվացման գործընթացը՝ ածխածնի մեջ մակերևութային շերտի քայքայումը՝ դրանցում պարունակվող երկաթի կարբիդի և թթվածնի Fe3C+O2→3Fe+CO2 Fe3C+CO2 թթվածնի և թթվածին պարունակող ռեակտիվների հետ փոխազդեցության պատճառով։ →3Fe+2CO Fe3C+H2O→3Fe+CO + H2. 26 Գազային միջավայրի կազմը մեծ ազդեցություն ունի պողպատի և չուգունի օքսիդացման արագության վրա: Գազային կոռոզիայի դեպքում ագրեսիվ նյութեր կարող են լինել, օրինակ, քլորը, ծծմբի միացությունները, թթվածինը, օդը, յոդի միացությունները և այլն: Նրանց ագրեսիվությունը տարբեր մետաղների նկատմամբ նույնը չէ, հետևաբար, կոռոզիայի արագությունը տատանվում է: Այսպիսով, Fe, Co, Ni-ի օքսիդացման արագությունը 900 °C ջերմաստիճանում աճում է H2O → CO2 → O2 → SO2 կարգով։ Այս դեպքում մետաղները, կախված այդ ռեագենտների մթնոլորտում կոռոզիայի արագությունից, դասավորված են աճող շարքով՝ Ni → Co → Fe։ Եթե ենթադրենք, որ օդում կոռոզիայի արագությունը 900 °C ջերմաստիճանում կազմում է 100%, ապա 2% SO2-ի ավելացումը այս ցուցանիշը մեծացնում է մինչև 118%, 5% H2O մինչև 134%, 2% SO2 + 5% H2O մինչև 276%: 2.5.2. Կոռոզիան վառելիքի այրման արտադրանքի ազդեցության տակ Վառելիքի այրման արտադրանքները (ածուխ, մազութ և այլն) շատ դեպքերում պարունակում են զգալի քանակությամբ ծծմբային միացություններ (SO2, H2S) և վանադիում V2O5 տեսքով, որն ուժեղ օքսիդացնող նյութ է: Ցածր հալեցման վանադիումի օքսիդը փոխազդում է մետաղի մակերեսի կշեռքի պաշտպանիչ շերտի հետ՝ քայքայելով այն և ձևավորելով վանադատներ, որոնք ստեղծում են էվտեկտիկա11 ցածր հալման կետով Fe2O3 + V2O5 → 2FeVO4 վանադիումի օքսիդի V2O5-ով։ Այսպիսով, երկաթի վանադատը (FeVO4) ունի հալման կետ = 840 °C, իսկ նրա էվեկտիկայի հալման կետը V2O5-ի հետ կազմում է 625 °C; Քրոմի վանադատի CrVO4-ի հալման կետը 810 °C է, իսկ էվեկտիկական V2O5-ի հետ՝ 665 °C։ Այնուհետեւ վանադատը ակտիվորեն մասնակցում է հենց մետաղի օքսիդացման գործընթացին 6FeVO4+4Fe→ 5Fe2O3 + 3V2O3 4Fe+ 3V2O5→ 2Fe2O3 + 3V2O3 V2O3+O2→ V2O5, իսկ ինքը V2O5-ը գործնականում չի սպառվում։ Առավելագույն չափով վանադիումի կոռոզիան ազդում է վառարանների կծիկների, հենարանների և միջնապատերի վրա, որոնք գործում են 620 – 700 °C ջերմաստիճանի միջակայքում: Էվեկտիկական (հունարեն éutektos - հեշտությամբ հալվող), հեղուկ համակարգ (լուծույթ կամ հալված), որը գտնվում է տվյալ ճնշման տակ պինդ փուլերի հետ հավասարակշռության մեջ, որոնց թիվը հավասար է համակարգի բաղադրիչների թվին։ 11 27 Միևնույն ժամանակ, նույնիսկ քրոմի և քրոմ-նիկելային պողպատների կոռոզիայի արագությունը, որոնք հակված չեն բարձր ջերմաստիճան ջրածնի սուլֆիդային կոռոզիայի, հասնում է 15 մմ/տարի։ Ծծմբային միացությունների ազդեցության տակ երկաթ-ածխածնային պողպատները ենթարկվում են ինտենսիվ միջգրանուլային կոռոզիայի՝ սուլֆիդների բյուրեղային ցանցերի ավելի մեծ թվով թերությունների պատճառով, քան օքսիդները: Սա հանգեցնում է դիֆուզիոն գործընթացների ինտենսիվացման: Այրման արտադրանքներում ածխածնի երկօքսիդի (II) պարունակության աճով զգալիորեն նվազում է ածխածնի և ցածր լեգիրված պողպատների գազային կոռոզիայի արագությունը: Սակայն դրա շատ բարձր կոնցենտրացիան հանգեցնում է մակերեսի կարբյուրացմանը՝ 3Fe+2CO→Fe3С+CO2։ X40N50 տիպի բարձր համաձուլվածքով համաձուլվածքները դիմացկուն են վանադիումի կոռոզիայից: Սիլիցիումի ներմուծումը պողպատի մեջ նաև դրական ազդեցություն ունի պողպատի լեգիրումը մոլիբդենի, վոլֆրամի և վանադիումի հետ բացասաբար է անդրադառնում պողպատի երկարակեցության վրա, քանի որ այս լեգիրման տարրերը նպաստում են12 V2O5-ի ձևավորմանը: Cu-ի վրա հիմնված համաձուլվածքները խիստ ենթակա են նման կոռոզիայի: Վանադիումի կոռոզիայի արագությունը նվազեցնելու համար ներկայումս օգտագործվում է հետևյալը. - սահմանափակել աշխատանքային ջերմաստիճանը մինչև 650 °C; - X40N50 տիպի համաձուլվածքների օգտագործումը այս տեսակի ոչնչացման ենթակա բաղադրիչների արտադրության համար. - մագնեզիումի և ալյումինի օքսիդներ պարունակող վառելիքի դոլոմիտի փոշու մեջ փչելը, որոնք վանադիումի օքսիդով հրակայուն միացություններ են կազմում. − սահմանափակում նատրիումի և վանադիումի ընդհանուր պարունակությունը վառելիքում մինչև 2 10–4%։ 2.5.3. Կոռոզիան քլորի և ջրածնի քլորիդի միջավայրում Մետաղների վարքագիծը գազային քլորի և քլորաջրածնի միջավայրում սկզբունքորեն տարբերվում է այլ ագրեսիվ միջավայրերի ազդեցությունից: Դա պայմանավորված է նրանով, որ մետաղի մակերեսին առաջացող քլորիդային աղերը ունեն ցածր հալման ջերմաստիճան, իսկ որոշ դեպքերում, երբ ջերմաստիճանը բարձրանում է, սուբլիմացվում են13, օրինակ Ti + 2Cl2 → TiCl4։ Խթանում – (հոմանիշներ) քշել, առաջ տանել, ուղղորդել։ Սուբլիմացիան նյութի անցումն է պինդ վիճակից գազային վիճակի՝ շրջանցելով հեղուկ փուլը. նույնը, ինչ սուբլիմացիա. 12 13 28 Այս ռեակցիաների մեծ մասը էկզոթերմիկ են: Ջերմության հեռացման արագությունը պարզվում է, որ ավելի ցածր է, քան բուն ռեակցիայի արագությունը, որի արդյունքում մետաղները բռնկվում են և «այրվում» քլորի մթնոլորտում: Սա հանգեցնում է ջերմաստիճանի զգալի տեղական աճի, և արդյունքում քլորիդները հալվում և քայքայվում են: Քլորի նկատմամբ առավել դիմացկուն են նիկելի, կապարի և քրոմի պողպատները։ Որոշ մետաղների բոցավառման ջերմաստիճանը չոր քլորի մթնոլորտում. o t բռնկում: Ti-ի հետ< 20 Pb 90−100 Fe 150 Cu 200 Ni > 500. Սենյակային ջերմաստիճանում չոր ջրածնի քլորիդում մի շարք մետաղներ և համաձուլվածքներ ունեն բավարար դիմադրություն: Ջերմաստիճանի բարձրացման հետ մետաղական նյութերի դիմադրությունը աստիճանաբար նվազում է մինչև յուրաքանչյուր մետաղին հատուկ ջերմաստիճան: Չոր քլորի և քլորաջրածնի մեջ մետաղների և համաձուլվածքների երկարատև շահագործման ընթացքում թույլատրելի առավելագույն բարձր ջերմաստիճանները բերված են աղյուսակում: 2. Չոր քլորի մեջ ամենադիմացկուն մետաղները, բացառությամբ ազնիվ մետաղների, նիկելն է և դրա համաձուլվածքները։ Նիկելի և քրոմ-նիկելային պողպատների վրա ձևավորված մակերեսային թաղանթները ունեն ցածր անկայունություն և բավարար պաշտպանիչ հատկություններ: Աղյուսակ 2 Որոշ մետաղներ և համաձուլվածքներ ջրածնի քլորիդի և քլորի մթնոլորտում աշխատելիս թույլատրելի ջերմաստիճանները3] T, °C Նյութ Cl2 1200 − − 550 − 100 150 300 − Պլատին ոսկի վոլֆրամ նիկել ինկոնել (80% Ni, 14): 6% Fe) Պղինձ Ածխածնային պողպատ St.Z Չժանգոտվող պողպատ 12Х18Н9Т Արծաթ 29 HCl 1200 870 600 510−600 480 100−120 260−350 450−500 230 2.5.4. Պողպատի ջրածնային կոռոզիան Ջրածնային կոռոզիան կարող է ուղեկցել բազմաթիվ տեխնոլոգիական գործընթացների, որոնք տեղի են ունենում 200°C-ից բարձր ջերմաստիճանի և 300 ՄՊա ճնշման դեպքում ջրածին պարունակող միջավայրերում: Այս պայմանները համապատասխանում են այնպիսի գործընթացների, ինչպիսիք են ածխի և նավթի ջրածացումը, ամոնիակի և մեթանոլի սինթեզը և այլն: Դիտարկվում է ջրածնի կողմից մետաղի վնասման երկու տեսակ՝ ՋՐԱԾՆՈՎ Փխրուն և ՋՐԱԾՆՈՎ ԿՈՐՈԶԻԱ: Հաճախ այդ երեւույթները համընկնում են միմյանց: Եթե գազում առկա է ամոնիակ, ապա կարող է տեղի ունենալ նաև ՄԵՏԱՂԻ ԱԶՈՏԱՑՈՒՄ։ Երբ ազոտ-ջրածին խառնուրդը շփվում է մետաղի հետ բարձր ջերմաստիճանի և ճնշման պայմաններում, մոլեկուլային ջրածինը տարանջատվում է մետաղի մակերեսի վրա: Ստացված ատոմային ջրածինը ցրվում է մետաղական ցանցի մեջ և լուծվում դրա մեջ։ Քանի որ ջերմաստիճանը նվազում է լուծելիության նվազման պատճառով, ջրածինը հակված է մետաղի ներսում գազային վիճակի անցնելու: Այս դեպքում մետաղի մեջ առաջանում են մեծ լարումներ՝ հանգեցնելով անդառնալի փխրունության։ Ջրածնի կոռոզիան պողպատի կարբիդային բաղադրիչի հետ ջրածնի քիմիական փոխազդեցության արդյունք է: Արտաքինից ջրածնի կոռոզիայի դրսևորումը նշանակում է պողպատի ամրության ուժեղ նվազում՝ առանց մակերեսի նկատելի ոչնչացման։ Ջրածնի կոռոզիայի մեխանիզմը ներառում է հետևյալ փուլերը. - բարձր ջերմաստիճանի դեպքում մոլեկուլային ջրածինը տարանջատվում է ատոմների, որոնք կլանվում են պողպատի մակերեսով և ցրվում նրա բյուրեղային ցանցի մեջ. − Լինելով ակտիվ վերականգնող նյութ՝ ատոմային ջրածինը նվազեցնում է երկաթի կարբիդը և փոխազդում է պողպատում լուծված ածխածնի հետ անշրջելի ռեակցիաների միջոցով՝ Fe3C + 2H2 3Fe + CH4 C + 4H CH4, այդպիսով պողպատը զրկելով իր ամրացնող հիմքից: Քանի որ դիֆուզիոն գործընթացները, ներառյալ ջրածնի շարժումը, առավել հեշտությամբ իրականացվում են հատիկների սահմանների երկայնքով, որտեղ հիմնականում տեղակայված են ցեմենտիտային թիթեղները, ջրածնի կողմից դրանց ոչնչացումը հանգեցնում է բյուրեղների միջև կապի խաթարմանը և, համապատասխանաբար, պողպատի ճկունության նվազմանը: . 30 Ստացված մեթանը ունի մեծ մոլեկուլային չափ՝ համեմատած ֆերիտի բյուրեղային ցանցի պարամետրերի հետ։ Արդյունքում, այն չի կարող ցրվել մետաղի մեծ մասից և կուտակվում է նրա միկրոխոռոչներում և արատներում՝ առաջացնելով ներխոռոչի բարձր ճնշում և հանգեցնելով ճաքերի։ Այս դեպքում ճաքեր են առաջանում հացահատիկի սահմանների երկայնքով: Ցածր ամրության հատկություններով մեղմ պողպատներում մեթանի կուտակումները հիմնականում տեղի են ունենում մերձմակերևութային շերտում՝ առաջացնելով այտուցներ, որոնք հստակ տեսանելի են պողպատի մակերեսին: Բացի մեթանի առաջացմանը մասնակցելուց, ջրածինը լավ լուծելիություն ունի մետաղում։ Մետաղում լուծված ջրածնի կոնցենտրացիան կախված է ջրածնի մասնակի ճնշումից մետաղ-գազի միջերեսում և կարող է որոշվել բանաձևով. 100 գ; p – ջրածնի մասնակի ճնշում, ժամը; Ks – ջրածնի լուծելիությունը պողպատում p = 1 at: Քանի որ մետաղի կողմից ջրածնի տարրալուծումը էնդոթերմային գործընթաց է, ջրածնի լուծելիությունը մեծանում է ջերմաստիճանի բարձրացման հետ: Այս երեւույթը կոչվում է ՋՐԱԾՆԱթափանցելիություն (VH) 4]: Պողպատի ջրածնային թափանցելիությունը կախված է նրանում ածխածնի և համաձուլվածքային տարրերի պարունակությունից և նվազում է ածխածնի պարունակության աճի հետ, ինչպես վկայում են աղյուսակում տրված տվյալները: 3. Աղյուսակ 3 Ածխածնի պարունակության ազդեցությունը ածխածնային պողպատների ջրածնային թափանցելիության վրա Մետաղ C, wt.% VН, cm3/cm2h մմ–1 Տեխնիկական երկաթ 0.04 5.10 Պողպատ 15 0.15 4.09 Պողպատ 30 0.27 2.79 Պողպատ 30 0.27 2.79 Պողպատ U102 կոռոզիա չի առաջանում. անմիջապես այն պահից, երբ պողպատը ենթարկվում է ջրածնի, բայց որոշակի ժամանակահատվածից հետո: Այս ժամանակը, որի ընթացքում պողպատի միկրոկառուցվածքի և մեխանիկական հատկությունների փոփոխություններ չկան, կոչվում է ՊՈՂԱՂԻ ԴԵԿԱՐԲԱՐՄԱՆ ԳՈՐԾԸՆԹԱՑԻ ԻՆԿՈՒԲԱՑԻՈՆ ԺԱՄԱՆԱԿ։ 31 Ինկուբացիոն շրջանը մեծ գործնական նշանակություն ունի, քանի որ այն էապես որոշում է սարքավորման անվտանգ շահագործման ժամանակը: Ինկուբացիոն շրջանը հիմնականում կախված է ջերմաստիճանից և ճնշումից։ Ջերմաստիճանի և ճնշման բարձրացմամբ ինկուբացիոն շրջանը նվազում է։ Միևնույն ժամանակ, ինկուբացիոն շրջանի տեւողությունը մեծապես ազդում է պողպատի քիմիական կազմից: Ջրածնի ջերմաստիճանը և մասնակի ճնշումը ազդում են ոչ միայն ինկուբացիոն շրջանի տեւողության վրա, այլեւ ջրածնային կոռոզիայի ժամանակ պողպատի դեկարբյուրացման արագության վրա: 2.5.5. Կարբոնիլային կոռոզիա Կարբոնիլային կոռոզիան տեղի է ունենում տեխնոլոգիական գործընթացներում, որոնք ներառում են ածխածին բարձր ճնշման և ջերմաստիճանի դեպքում: Նման գործընթացները ներառում են, օրինակ, մեթիլ և բուտիլ սպիրտների արտադրությունը, մեթանի և ածխածնի օքսիդի փոխակերպումը։ Սովորական պայմաններում CO-ն իներտ է մետաղների նկատմամբ։ Բարձր ջերմաստիճանների և ճնշման դեպքում ածխածնի օքսիդը փոխազդում է բազմաթիվ մետաղների հետ և ձևավորում կարբոնիլներ։ Օրինակ Fe + nCO = Fe(CO)n: Երկաթը և CO-ն կարող են ձևավորել երեք միացություններ՝ տետրակարբոնիլ՝ Fe(CO)4, հնգաքարբոնիլ՝ Fe(CO)5 և նանոկարբոնիլ՝ Fe(CO)g: Այս բոլոր միացությունները բավականին անկայուն են և քայքայվում են, երբ ջերմաստիճանը բարձրանում է: Դրանցից ամենակայուն միացությունը Fe(CO)5-ն է։ Կարբոնիլների առաջացումը մեծանում է 100 ºС ջերմաստիճանի բարձրացման հետ, այնուհետև 140 – 180 ºС ջերմաստիճանի միջակայքում նկատվում է դրանց գրեթե ամբողջական տարանջատումը Fe և CO: Ածխածնի երկօքսիդը (II) կարող է նմանատիպ միացություններ առաջացնել բազմաթիվ այլ մետաղների հետ։ Կարբոնիլային կոռոզիան առաջացնում է մետաղի մակերեսային շերտի ոչնչացում և թուլացում մինչև 5 մմ խորություն: Մակերեւույթից ավելի մեծ հեռավորության վրա գտնվող մետաղի կառուցվածքի փոփոխություններն այլևս չեն առաջանում: 2.5.6. Կոռոզիան ոչ էլեկտրոլիտներում ՈՉ ԷԼԵԿՏՐՈԼԻՏՆԵՐԸ հեղուկներ են, որոնք էլեկտրական հոսանք չեն փոխանցում: Անօրգանական ծագման հեղուկ քայքայիչ միջավայրեր՝ հեղուկ բրոմ, հալած ծծումբ և այլն։ Հեղուկ օրգանական նյութեր՝ բենզոլ, քլորոֆորմ և այլն, հեղուկ վառելիք (նավթ, կերոսին, բենզին և այլն), քսայուղեր։ Մաքուր տեսքով դրանք ցածր ագրեսիվ են, սակայն դրանցում նույնիսկ փոքր քանակությամբ կեղտերի առկայությունը (մերկապտաններ14, ջրածնի սուլֆիդ, ջուր, թթվածին և այլն) կտրուկ մեծացնում է նրանց քիմիական ակտիվությունը։ Այսպիսով, հում նավթում պարունակվող մերկապտանները և ջրածնի սուլֆիդը առաջացնում են Fe, Cu, Ni, Ag, Pb, Sn կոռոզիա՝ համապատասխանաբար դրանց մերկապտիդների (Me−(S−R)n) և պոլիսուլֆիդների (Me2Sx) ձևավորմամբ։ Ածխածնի տետրաքլորիդում ջրի հետքերը մեծացնում են դրա քայքայումը՝ հիդրոլիզի և էլեկտրաքիմիական մեխանիզմով կոռոզիայի առաջացման հետևանքով հաղորդիչ բաղադրիչների (HCl) ձևավորման պատճառով՝ CCl4 + H2O → COCl2 + 2HCl CCl4 + 2H2O + kаt → CO2 + 4HCl: Հիմնականում մետաղների կոռոզիան ոչ էլեկտրոլիտներում տեղի է ունենում քիմիական մեխանիզմով: Այս գործընթացը բաղկացած է մի քանի փուլից, որոնցից յուրաքանչյուրը որոշում է կոռոզիայի արագությունը. 2) օքսիդացնող նյութի քիմիզորբցիա. 3) քիմիական ռեակցիա. 4) կոռոզիոն արտադրանքի կլանումը մետաղի մակերեսից. 5) կոռոզիոն արտադրանքի դիֆուզիոն ոչ էլեկտրոլիտի ծավալի մեջ. Որոշ դեպքերում կոռոզիոն արտադրանքներից մետաղի մակերեսի վրա ձևավորվում է պաշտպանիչ թաղանթ, ինչը հանգեցնում է կոռոզիայի գործընթացի արգելակմանը օքսիդացնողի մետաղի մակերեսին տարածման դժվարության պատճառով: Կախված ստացված թաղանթի պաշտպանիչ հատկություններից և դրա լուծելիությունից, կարող է տեղադրվել գործընթացի դիֆուզիոն, կինետիկ կամ խառը դիֆուզիոն-կինետիկ հսկողություն: Ջերմաստիճանը զգալիորեն ազդում է ոչ էլեկտրոլիտներում մետաղների քիմիական կոռոզիայի արագության վրա (տես բաժին 2.4): Ջերմաստիճանի ազդեցությունը պրոցեսի արագության վրա որոշ դեպքերում բարդանում է օքսիդիչի լուծելիության և մետաղական կորոզիայի արտադրանքի թաղանթի փոփոխությամբ ոչ էլեկտրոլիտում, երբ ջերմաստիճանը փոխվում է: 14 Մերկապտանները ածխաջրածինների հիդրոսուլֆիդային ածանցյալներ են՝ R – S –H: 33 Ոչ էլեկտրոլիտներում ջրի առկայությունը զգալիորեն ակտիվացնում է կեղտերի քայքայիչ ազդեցությունը և առաջացնում մետաղների ինտենսիվ էլեկտրաքիմիական կոռոզիա, այսինքն. կոռոզիայի գործընթացի մեխանիզմը փոխվում է. Ոչ էլեկտրոլիտներում մետաղները քիմիական կոռոզիայից պաշտպանելու համար ընտրվում են մետաղներ և համաձուլվածքներ, որոնք կայուն են տվյալ միջավայրում (օրինակ՝ ալյումինը և դրա համաձուլվածքները կայուն են ճաքած բենզինի մեջ), և կիրառվում են պաշտպանիչ ծածկույթներ (օրինակ՝ պողպատը ջրածնի սուլֆիդի միջավայրը պատված է ալյումինով): 2.6. Մետաղները տարբեր տեսակի գազային կոռոզիայից պաշտպանելու մեթոդներ 2.6.1. Գազի կոռոզիայից պողպատը պաշտպանելու մեթոդներ Գազային կոռոզիայից պողպատը պաշտպանելու համար առավել լայնորեն օգտագործվում են ջերմակայուն ՀԱԼՈՒՍԱՑՄԱՆ և ՊԱՇՏՊԱՆԱԿԱՆ ԾԱԾԿԵՐՆԵՐԸ: Լեգիրում - (գերմաներեն legieren - «միաձուլել», լատիներեն ligare - «կապել») - նյութերի բաղադրության մեջ կեղտերի ավելացում՝ հիմնական նյութի ֆիզիկական և/կամ քիմիական հատկությունները փոխելու (բարելավելու) համար: Մետաղները բարձր ջերմաստիճանում օքսիդացումից պաշտպանելու հիմնական մեթոդները հիմնված են ՀԱՄԱՁԳՄԱՆ վրա: Բարձր ջերմաստիճաններում օքսիդացված մետաղների դիմադրությունը կախված է մետաղը ծածկող օքսիդային թաղանթի պաշտպանիչ հատկություններից: Երկաթ-ածխածնային համաձուլվածքների վրա պաշտպանիչ շերտի ստեղծմանը նպաստող տարրերն են քրոմը, ալյումինը և սիլիցիումը։ Այս տարրերը օդում բարձր ջերմաստիճաններում ավելի հեշտությամբ օքսիդանում են, քան համաձուլված մետաղը և կազմում ավելի կայուն մասշտաբներ: Ջերմակայուն համաձուլման տեսության համաձայն՝ համաձուլվածքային բաղադրիչը մետաղի մակերեսի վրա ստեղծում է պաշտպանիչ շերտ, որը բաղկացած է միայն համաձուլվածքի բաղադրիչի օքսիդից։ Լեգիրման տարրը պետք է բավարարի հետևյալ հիմնական պահանջներին՝ մետաղի մակերեսին առաջացած օքսիդը պետք է լինի շարունակական, այսինքն. Vok/VMe հարաբերակցությունը պետք է լինի >1: Օքսիդային շերտը պետք է ունենա բարձր օմիկ դիմադրություն rMeO > rFe, համաձուլվածքային բաղադրիչ իոնների չափերը պետք է լինեն ավելի փոքր, քան հիմնական մետաղի իոնների չափերը, այսինքն. rMe< rFe. Это условие вытекает из следующих соображений: 34 а) меньший радиус иона легирующего компонента по сравнению с ионом основного металла позволяет предполагать у легирующего компонента больший коэффициент диффузии в сплаве, что может обеспечить преимущественный выход ионов компонента на поверхность сплава и, следовательно, преимущественное образование оксида легирующего компонента; б) меньший радиус иона легирующего компонента позволит образовать оксид с соответствующими меньшими параметрами, который будет оказывать большое сопротивление диффузии через него и, следовательно, создавать большое затруднение для окисления основного металла. Это подтверждается сравнением размеров ионных радиусов железа и легирующих элементов: хрома, алюминия и кремния Ион металла Ионный радиус, Аº Fe2+ 0,74 Cr6+ 0,52 Al3+ 0,50 Si4+ 0,41. А энергия образования оксида легирующего компонента должна быть больше энергии образования оксида основного металла ΔGMeO<ΔGFeO. Если это условие не соблюдается, то оксид легирующего компонента будет восстанавливаться основным компонентом, как например, оксидная пленка меди, которая не может быть устойчивой на железном сплаве вследствие возможности протекания реакции CuO+Fe → FeO+Cu. При этом необходимо соблюдение условий: высокая температура плавления оксида легирующего компонента, низкая упругость диссоциации, а также отсутствие низкоплавких эвтектик в смеси с другими оксидами для того, чтобы оксид легирующего компонента был достаточно устойчив. В качестве примера можно привести элемент бор, который является аналогом Al по таблице Менделеева, но дает легкоплавкие оксиды. Температура плавления ВО3 − 294 0С, и поэтому бор, в отличие от алюминия, не может быть легирующим компонентом, повышающим жаростойкость. Необходимым условием является также, образование твердых растворов между легирующими компонентами и основным металлом, так как при этом условии возможно равномерное распределение этого элемента на поверхности и образование сплошной пленки оксида легирующего компонента. 35 Существует и другая теория, согласно которой легирующий элемент образует на поверхности сплава смешанные оксиды, обладающие повышенными защитными свойствами, по сравнению с оксидами чистых компонентов. Механизм повышения жаростойкости можно свести к тому, что легирующий компонент должен уменьшить возможность образования в окалине вюститной фазы (FeO) на стали и, таким образом, благоприятствовать образованию шпинельной фазы типа Fe3O4ּγFe2O3 с возможно меньшим параметром решетки. Жаростойкие легированные стали имеют на поверхности оксидные слои со структурой именно шпинели. Еще более высокими защитными свойствами обладают сложные шпинели типа FeOּMe2O3 или Fe2O3 ּMeO. С целью экономии легированных сталей жаростойкость углеродистых сталей повышают, применяя защитные покрытия. Для нанесения на сталь защитных покрытий пользуются следующими методами: ТЕРМОДИФФУЗИОННЫМ, НАПЛАВКОЙ И ПЛАКИРОВАНИЕМ. Для нанесения покрытий термодиффузионным методом стальное изделие после очистки поверхности механическим способом и травлением помещают в реакционную смесь, состоящую из порошка наносимого металла и катализатора. Например, при нанесении алюминиевых покрытий смесь содержит измельченный ферроалюминиевый и хлористый аммоний. Процесс насыщения поверхности стали алюминием (АЛИТИРОВАНИЕ) производится при высоких температурах (900−9500С), в результате чего происходит разложение хлористого аммония на аммиак и хлористый водород: NH4Cl → NH3 + HCl, который, в свою очередь, взаимодействует с алюминием 2Al +6HCl → 3H2 + 2AlCl3. На поверхности стального изделия происходит выделение атомарного алюминия AlCl3 +Fe → FeCl3 + Al, который диффундирует в сталь. Значительное повышение жаростойкости стали термодиффузионным покрытием обусловлено образованием окислов Al2O3 или двойных окислов FeAl2O4 в алитированном слое. На поверхности хромированных или силицированных изделий образуются соответствующие оксиды хрома или кремния. 36 НАПЛАВКА − это нанесение слоя металла или сплава на поверх- ность изделия посредством сварки плавлением. ПЛАКИРОВА́НИЕ − (фр. plaquer − накладывать, покрывать) термомеханическое покрытие − нанесение на поверхность металлических листов, плит, проволоки, труб тонкого слоя другого металла или сплава термомеханическим способом. Для защиты от карбонильной коррозии применяют хромистые стали с содержанием 30 % Сг, хромоникелевые стали с содержанием 23 % Сг и 20 % № и марганцевые бронзы доя работы при температуре до 700 °С и давлении до 35 МПа. При более низких параметрах возможно применение менее легированных сталей типа Х18Н9. Сырьем для синтеза мочевины CO(NH2)2 является NH3 и СО2. Процесс протекает при температуре 175−190°С и давлении 20 МПа. Хромистые нержавеющие стали различных марок непригодны для изготовления основных аппаратов. Наибольшую стойкость имеют стали, легированные молибденом, и хромникельмолибденовомедные стали. Важным фактором для повышения коррозионной устойчивости является тщательная очистка газов от сероводорода и дополнительное введение в систему кислорода в количестве 0,5- 1,0 об.% от содержания СО2. При сернистой коррозии сера и ее соединения - сернистый ангидрид (SO2), сероводород (H2S), меркаптаны или тиоспирты и т.д. являются достаточно агрессивными, коррозионно−активными веществами. Наиболее активным компонентом при высокотемпературной газовой коррозии является сероводород. Он даже более опасен, чем диоксид серы. Сернистый газ SO2 является исходным продуктом при производстве серной кислоты. Его получают при обжиге серного колчедана, сжигании серы, из сероводорода при утилизации отходящих газов металлургических производств. Чугунные детали скребков конверторных печей кипящего слоя, зубья и гребки колчеданных печей, котлы−утилизаторы, сухие электрофильтры, газоходы обжиговых газов в производстве серной кислоты часто выходят из строя вследствие газовой коррозии. В результате коррозии черных металлов в сернистом газе при температурах 300°С и выше образуется слоистая окалина, состоящая из FeS, FeO и др. 37 При температуре газа более 400 °С для деталей из чугуна характерно увеличение объема металла, достигающего 10 % от начальной величины. При этом резко снижается прочность материала. Детали испытывают коробление, трескаются и разрушаются. Это явление называется «ростом» чугуна и объясняется внутренним окислением металла. Максимальный рост чугуна наблюдается при 700 °С. К ростоустойчивым чугунам относятся высоколегированные хромистые чугуны, карбидный чугун типа «пирофераль» и «чугаль» Сернистый газ при высоких температурах окисляет никель. При этом образуется окалина, в состав которой входят NiS и NiO: 3Ni + S02 = NiS + 2NiO. Сернистый никель образуется и при действии на металл сероводорода: Ni + H2S = NiS + Н2. Сульфид никеля с металлическим никелем образует легкоплавкую эвтектику с температурой плавления около 625 °С. Образование этой эвтектики в сталях, содержащих никель, происходит преимущественно по границам зерен, вызывая разрушение металла. Стали с содержанием никеля выше 15 % очень чувствительны к действию сернистого газа. В процессе окисления они теряют механическую прочность. Поэтому при работе с газовой средой, содержащей диоксид серы, при температурах до 400 °С используют углеродистые стали, а при более высоких температурах − хромистые стали. Наиболее употребительны жаростойкие стали − 4Х9СА, Х6СЮ, XI7, ОХ 17 Г, X1800, Х25Т. Интенсивное образование окалины происходит при температурах выше 800−1000 °С. К жаропрочным сталям в этой среде относятся Х5М, Х6СМ, XI8Н12Т, Х23Н18. Рабочая температура для этих сплавов 550−600 °С (для Х23Н18 − 1000 °С). Сухой сернистый газ реагирует с алюминием очень медленно. Поэтому алюминий используют для защиты от коррозии деталей и узлов теплообменников и контактных аппаратов. Сухой сероводород при комнатной температуре не представляет опасности для обычных углеродистых сталей. С повышением температуры опасность сероводородной коррозии углеродистых сталей значительно увеличивается. При температуре выше 300 °С 38 железо подвергается сильной коррозии в серосодержащих газовых средах. Легирование хромом в количестве > 12%-ով բարձրացնում է կոռոզիոն դիմադրությունը մինչև 700−800 °C ջերմաստիճանում: Երբ քրոմային պողպատները կոռոզիայի են ենթարկվում, առաջանում են թեփուկներ, որոնց արտաքին շերտը բաղկացած է երկաթի սուլֆիդից։ Այս շերտում գործնականում քրոմ չկա: Ամբողջ օքսիդացված քրոմը կենտրոնացած է ներքին շերտում, որն ունի պաշտպանիչ հատկություն։ Ֆերիտիկ Նկ. 5 10 15 20 ունեն լավ քիմիական դիմադրություն ծծմբ-Cr, wt.% ջրածնի մթնոլորտում: 6. 25–30% պինդ պողպատ պարունակող քրոմի համաձուլվածքների կոռոզիայի արագությունը նավթի գոլորշիներում 650 °C ջերմաստիճանում: Կորերի վրա թվերը ցույց են տալիս քրոմը: H2S պարունակությունը, % Հատկապես վտանգավոր է ծծմբի միացությունների և այլ քայքայիչ բաղադրիչների համակցված առկայությունը: Այսպիսով, նավթային արդյունաբերության մեջ ծծմբային յուղերի ջերմային մշակման ժամանակ հատուկ վտանգ է ներկայացնում ջրածնի սուլֆիդի և ջրածնի խառնուրդը։ Նկ.-ում ցուցադրվածներից: 6 տվյալները ցույց են տալիս, որ քրոմի պողպատների կոռոզիայի արագությունը մեծանում է նավթի գոլորշիներում ջրածնի սուլֆիդի կոնցենտրացիայի աճով: Այս դեպքում H2S-ի կոնցենտրացիայի 10 անգամ ավելացումը հանգեցնում է կոռոզիայի արագության ավելացմանը ավելի քան 12-15 անգամ: Վառելիքի այրման ժամանակ առաջանում են բարդ գազային խառնուրդներ, որոնք պարունակում են O2 և տարբեր օքսիդներ, այդ թվում՝ ծծմբի կեղտեր: Այս դեպքերում նկատվում է ՍՈՒԼՖԻԴ-ՕՔՍԻԴԻ կոռոզիա։ Մետաղի վրա պաշտպանիչ թաղանթը սովորաբար բաղկացած է մի քանի շերտերից: Արտաքին շերտը հարստացված է թթվածնով և բաղկացած է մետաղի օքսիդից, իսկ մետաղի մակերեսին հարող ներքին շերտերը պարունակում են ծծմբի և սուլֆիդների ավելացված քանակություն։ Եթե վառելիքի այրումից առաջանում է մոխիր, որը պարունակում է վանադիումի օքսիդ V2O5, ապա կոռոզիայի արագությունը շատ արագ աճում է։ Պողպատների վանադիումի կոռոզիայի պատճառները քննարկվել են ավելի վաղ (տես բաժին 2.5.2): 39 4−6% Cr պարունակող քրոմի պողպատները համարվում են կիսաջերմակայուն։ Այս դասի պողպատները, իրենց առկայության, կոռոզիոն դիմադրության և ամրության բարձրացման շնորհիվ, լայնորեն օգտագործվում են նավթարդյունաբերության մեջ՝ ճաքող ագրեգատների արտադրության համար: Այս պողպատների ջերմային դիմադրությունը օդում և ծխատար գազերում ծծմբի միացությունների զգալի պարունակությամբ 500−600 ºС ջերմաստիճանում մոտավորապես 3 անգամ ավելի բարձր է, քան չլեգիրված պողպատների ջերմային դիմադրությունը: 2.6.2. Ջրածնային կոռոզիայից պաշտպանվելու մեթոդները Պողպատների ջրածնային դիմադրությունը բարձրացնելու հիմնական միջոցներից մեկը դրանց համաձուլումն է ամուր կարբիդ կազմող տարրերով, որոնք ավելի կայուն կարբիդներ են կազմում, քան ցեմենտիտը: Այդպիսի տարրեր են քրոմը, վոլֆրամը, մոլիբդենը, վանադիումը, նիոբիումը, տիտանը։ Կարբիդային փուլի տեսակը մեծ ազդեցություն ունի պողպատի ջրածնային դիմադրության վրա: Քրոմի հետ համաձուլված պողպատներում ջրածնի դիմադրությունը նվազում է՝ կախված կարբիդային փուլի բաղադրությունից հետևյալ շարքերում՝ (Cr,Fe)23C6(Cr,Fe)23C6 + (Cr,Fe)7C3(Cr,Fe) 7C3 (Cr,Fe)7C3 + (Fe,Cr)3C(Fe,Cr)3C Վերոհիշյալ շարքը ցույց է տալիս, որ քրոմի պողպատներում ամենամեծ ջրածնային դիմադրությունը ձեռք է բերվում (Cr,Fe) կարբիդների առաջացմամբ։ )23C6 տիպ. Այս տեսակի կարբիդի ձևավորումը պողպատում ածխածնի պարունակությամբ 0,05% տեղի է ունենում, երբ պողպատում կա առնվազն 6% քրոմ, իսկ ածխածնի պարունակության ավելացման դեպքում անհրաժեշտ է քրոմի պարունակության ավելացում: Երբ պողպատը համաձուլում է ավելի ամուր կարբիդ ձևավորող տարրերով, քան քրոմը, պողպատի ամենամեծ ջրածնային դիմադրությունը ձեռք է բերվում, երբ այդ տարրերը պարունակվում են այն քանակությամբ, որը բավարար է ամբողջ ածխածինը MeC տիպի կարբիդների մեջ կապելու համար: Այն դեպքերում, երբ սարքավորումների տարրերը գործում են մեխանիկական բեռների բարձր մակարդակի պայմաններում, ջրածնակայուն պողպատները պետք է ունենան նաև ջերմակայունություն: Այս պայմանների համար օգտագործվում են 3% Cr պարունակող պողպատներ, որոնք լրացուցիչ համաձուլված են Mo, V կամ W-ով, օրինակ՝ պողպատի դասի 20Х3МВФ (EI579): Պողպատե դասարանները X5M, X5VF, X9M, 1X13 ունեն նույնիսկ ավելի մեծ դիմադրություն: Առավել ծանր պայմաններում օգտագործվում են աուստիկ ջերմակայուն քրոմ-նիկելային պողպատներ 0Х18Н10Т կամ Х17Н17М2Т։ 40 Պողպատների ջրածնային դիմադրության բարձրացման մեկ այլ լայնորեն կիրառվող մեթոդ է դրանք պատել մետաղներով, որոնք ունեն ավելի ցածր ջրածնային թափանցելիություն, քան հիմնական մետաղը: Սա հնարավորություն է տալիս նվազեցնել ջրածնի կոնցենտրացիան հիմնական մետաղի և երեսպատման շերտի միջերեսում և նվազեցնել դրա ագրեսիվ ազդեցությունը հիմնական մետաղի վրա: Ջրածնի արդյունավետ ճնշման հաշվարկը հիմք-ծածկույթի մետաղի միջերեսում իրականացվում է հետևյալ հավասարման համաձայն. երեսպատման շերտ; p2-ը ջրածնի արդյունավետ ճնշումն է ծածկույթ-հիմնական մետաղի միջերեսում; = VН1/VН2 երեսպատման շերտի և բազային մետաղի համապատասխանաբար ջրածնային թափանցելիության հարաբերակցությունն է. = l1/l2 – համապատասխանաբար երեսպատման շերտի և հիմնական մետաղի հաստության հարաբերակցությունը: Ջրածնի թափանցելիության բարձրացման կարգով մետաղները և համաձուլվածքները կարելի է դասավորել անընդմեջ՝ ալյումին, պղինձ, նիկել, X18N10T, 0X13։ Գործնականում քիմիական և նավթավերամշակման արդյունաբերություններում հիմնականում օգտագործվում են ածխածնային կամ ցածր լեգիրված պողպատներից պատրաստված բիմետալներ՝ 0Х13 կամ Х18Н10Т պողպատների պաշտպանիչ շերտով։ Ընտրված պողպատից պատրաստված սարքավորումների աշխատանքային ջերմաստիճանը պետք է պահպանվի 25°C-ով ցածր այն ջերմաստիճանից, որի դեպքում հնարավոր է ջրածնային կոռոզիա: Գլուխ 3. ՄԵՏԱՂՆԵՐԻ ԷԼԵԿՏՐԱՔԻՄԻԱԿԱՆ ԿՈՐՈԶԻԱ 3.1. Մետաղների էլեկտրոդային պոտենցիալները Երբ մետաղը ընկղմվում է էլեկտրոլիտի մեջ, ֆազային սահմանում տեղի է ունենում պոտենցիալ թռիչք՝ կրկնակի էլեկտրական շերտի 5, 6 առաջացման պատճառով: Եթե մետաղական թիթեղը, օրինակ՝ պղնձե ափսեը, ընկղմվի ջրի կամ պղնձի աղի լուծույթի մեջ, ապա դրական լիցքավորված Cu2+ իոնները կսկսեն շարժվել ջրի սահմանին գտնվող մետաղական շերտից դեպի ջուր։ Այս դեպքում մետաղի բյուրեղային ցանցում առաջանում է էլեկտրոնների ավելցուկ, իսկ թիթեղը բացասական լիցք է ստանում։ Բացասական լիցքավորված ափսեի և լուծույթ անցած դրական իոնների միջև առաջանում է էլեկտրաստատիկ ձգում, ինչը կանխում է պղնձի իոնների հետագա անցումը լուծույթի մեջ, այսինքն՝ մետաղի լուծարման գործընթացը կանգ է առնում։ Միաժամանակ զարգանում է հակառակ պրոցեսը` լուծույթից պղնձի իոնները, մոտենալով թիթեղի մակերեսին, ընդունում են էլեկտրոնները դրանից և անցնում չեզոք վիճակի։ Որոշ ժամանակ անց հաստատվում է դինամիկ հավասարակշռության վիճակ, որի դեպքում իոնների մետաղից լուծույթ անցնելու արագությունը հավասար է լուծույթից մետաղի վրա իոնների արտանետման արագությանը: Նկարագրված երևույթը սխեմատիկորեն ներկայացված է Նկ. 7 (պարզության համար մետաղական իոնները ցուցադրվում են չհիդրված): Քննարկվող օրինակի համար լուծույթի իոնների և մետաղի հավասարակշռությունը արտահայտվում է հավասարմամբ՝ Cu2+р−р + 2ē Cuºբյուրեղ Էլեկտրաքիմիական ռեակցիայի հավասարակշռության հավասարման մեջ էլեկտրոնները սովորաբար գրվում են ձախ կողմում։ այսինքն, կրճատման գործընթացը գրված է: Նկ.7. Մետաղ-լուծույթի միջերեսում կրկնակի էլեկտրական շերտի տեսքի սխեման Ինչպես երևում է վերը նշված օրինակից, երբ մետաղը շփվում է իր աղի լուծույթի հետ, երկու շփվող փուլերը ստանում են հակադիր լիցքեր: Արդյունքում, փուլային միջերեսում ձևավորվում է կրկնակի էլեկտրական շերտ, և մետաղի և լուծույթի միջև տեղի է ունենում պոտենցիալ թռիչք (): Եթե տարբեր մետաղներից երկու մետաղական թիթեղներ (M1 և M11) իջեցվեն լուծույթի մեջ, ապա կառաջանա գալվանական զույգ, որի մեջ պակաս ակտիվ մետաղը կկրճատվի, իսկ ավելի ակտիվը կօքսիդանա (նկ. 8): Բրինձ. 8. Գալվանական բջիջի աշխատանքի սխեման Ընդհանուր առմամբ, այս գալվանական զույգի աշխատանքը որոշվում է պոտենցիալ տարբերությամբ (գալվանական բջիջի emf) և ուղեկցվում է կիսա-ռեակցիաների հավասարակշռությամբ՝ E = ox − red, որտեղ ox-ը օքսիդիչի պոտենցիալն է, V; red – նվազեցնող գործակալի պոտենցիալ, V. Men+(ox) + ne ⇆ Меº Meº(կարմիր) − ne ⇄ Меn+: Երբ մեկ միավոր ժամանակում լուծույթ անցնող կատիոնների թիվը հավասարվում է մետաղի մակերեսին նստած կատիոնների քանակին, տեղի է ունենում դինամիկ հավասարակշռություն և տարրալուծման գործընթացը կդադարի: Հետեւաբար, նման պայմաններում մեծ թվով մետաղի իոնների ատոմների անցումը լուծույթի անհնար է։ Այնուամենայնիվ, եթե էլեկտրական կրկնակի շերտի հավասարակշռությունը խախտվում է էլեկտրոնների լիցքաթափման կամ մետաղի իոնների ատոմների հեռացման արդյունքում, կոռոզիայի գործընթացը կշարունակվի անխոչընդոտ: Մետաղների էլեկտրոդային պոտենցիալները, որոնք հավասարակշռության մեջ են իրենց սեփական իոնների հետ, կոչվում են հավասարակշռություն: Հավասարակշռության ներուժի արժեքը կարող է հաշվարկվել ցանկացած իոնային ակտիվության համար՝ օգտագործելով Nernst հավասարումը. R – ունիվերսալ գազի հաստատուն, 8,3 կՋ/կմոլK; T - բացարձակ ջերմաստիճան, ºK; n - մետաղական վալենտություն; F – Faraday համարը 96500 C/mol; 43 aМen+ – մետաղական իոնների ակտիվություն մոլ/լ-ով: Եթե բոլոր հաստատունները փոխարինենք 25°C-ում (T = 298 Կ) և բազմապատկենք 2,3-ով բնական լոգարիթմներից տասնորդականների անցնելու համար, ապա կստանանք հետևյալ արտահայտությունը E = Eº + (0.0592/n)log(aMen+), ( 13) Երբ լուծումը նոսրացվում է, մետաղի ներուժը տեղափոխվում է բացասական կողմ: Եթե, օրինակ, Zn2+ իոնների ակտիվությունը ցինկի աղի լուծույթում 10–2 մոլ/լ է, ապա այս լուծույթում ընկղմված ցինկի հավասարակշռության պոտենցիալը հավասար կլինի՝ E = − 0,76 + (0,0592/2). lg10−2 = − 0,819 V, (14) Լուծույթում մետաղական իոնների կոնցենտրացիայի ավելացմամբ մետաղական ներուժը, ընդհակառակը, տեղաշարժվում է դրական ուղղությամբ։ Այսպիսով, եթե ցինկի իոնների ակտիվությունն ընդունվի 10 մոլ/լ, ապա ցինկի պոտենցիալը կլինի E = − 0,76 + (0,0592/2)log10 = − 0,73 Վ, (15) Մետաղների էլեկտրոդային պոտենցիալները, որոնցում փոխանակման գործընթացը, որը որոշում է պոտենցիալը, ներառում է ոչ միայն սեփական, այլև այլ իոններ և ատոմներ, որոնք կոչվում են ոչ հավասարակշռված կամ անշրջելի: Ոչ հավասարակշռված պոտենցիալների համար Nernst բանաձևը կիրառելի չէ, քանի որ մետաղի վրա տեղի ունեցող ռեակցիաները, այսինքն. էլեկտրոնների կորուստը և ձեռքբերումը տեղի են ունենում տարբեր ձևերով, և պոտենցիալը չի կարող բնութագրել էլեկտրոդում որևէ ռեակցիայի հավասարակշռության սկիզբը: Ոչ հավասարակշռված պոտենցիալների մեծության վրա ազդում են էլեկտրոլիտի բնույթը, ջերմաստիճանը, էլեկտրոլիտի շարժումը, լուծույթի կոնցենտրացիան և այլն։ Օրինակ՝ 3% NaCl-ում ալյումինի պոտենցիալը − 0,6 Վ է, 0,05 Մ Na2SO4 − 0,47 Վ։ իսկ 0,05 M Na2SO4 + H2S − 0,23 V. Մետաղի կամ էլեկտրոլիտի մակերեսի էլեկտրաքիմիական տարասեռության պատճառով մետաղի վրա առաջանում են տարբեր պոտենցիալներով տարածքներ։ Մետաղական մակերևույթի էլեկտրաքիմիական տարասեռություն առաջացնող հիմնական պատճառները կարող են լինել հետևյալը. ; - պաշտպանիչ թաղանթի տարասեռություն. 44 – ֆիզիկական պայմանների տարասեռություն – անհավասար ջերմաստիճան մետաղի տարբեր հատվածներում, դեֆորմացված հատվածների առկայություն, սթրեսի խտացուցիչներ. − էլեկտրոլիտի տարասեռություն - թթվածնի կոնցենտրացիայի կամ աղի կոնցենտրացիայի տարբերություն, տարբեր pH արժեք: Ավելի բացասական պոտենցիալ ունեցող տարածքները կոչվում են ANODIC, ավելի դրական պոտենցիալ ունեցող տարածքները կոչվում են CATHODE: Մետաղական մակերեսի տարասեռության աստիճանը որոշվում է կաթոդի և անոդային հատվածների պոտենցիալների տարբերությամբ։ 3.2. Էլեկտրաքիմիական կոռոզիայի թերմոդինամիկա Կոռոզիայի գործընթացի ինքնաբուխ առաջացման հնարավորությունը որոշվում է ազատ էներգիայի (իզոբար-իզոթերմային պոտենցիալ) նվազմամբ G.< 0: G = −nFE < 0, (16) где n – эквивалентное число электронов; Е = К – А – эдс гальванического элемента, образующегося при контакте металла с окислителем в процессе коррозии; К – обратимый потенциал катодной реакции (окислителя); А – обратимый потенциал анодной реакции (металла – восстановителя); F – число Фарадея. Принципиальная возможность протекания процесса электрохимической коррозии металла имеет место при К > A կամ E > 0. Էլեկտրոլիտում օքսիդացնող նյութի հետադարձելի ռեդոքս պոտենցիալը այս պայմաններում պետք է ավելի դրական լինի, քան նույն պայմաններում մետաղի շրջելի պոտենցիալը: Մետաղների էլեկտրաքիմիական կոռոզիայի թերմոդինամիկական հնարավորության սահմանները սահմանելու համար կարող են օգտագործվել Պուրբեի դիագրամները։ Դիագրամները հակադարձելի էլեկտրոդների պոտենցիալների (ջրածնի սանդղակով վոլտներով) կախվածության գրաֆիկական պատկերացումներն են հավասարակշռության վիճակների համար լուծույթի pH-ից. էլեկտրոնների մասնակցությամբ՝ հորիզոնական գծեր. էլեկտրոնների և իոնների մասնակցությամբ H+ կամ OH– - թեքված գծեր. H+ և OH– իոնների մասնակցությամբ, բայց առանց էլեկտրոնների (հիդրատի ձևավորման pH արժեք)՝ ուղղահայաց գծեր։ 45 Նկ.9. Դիագրամ E – pH Al-H2O համակարգի համար 25°C-ում Որպես օրինակ Նկ. Նկար 9-ը ցույց է տալիս Pourbaix դիագրամը Al-H2O համակարգի համար: Գծապատկերի յուրաքանչյուր շրջան համապատասխանում է մեկ թերմոդինամիկորեն կայուն վիճակի՝ մետաղական վիճակի, լուծույթում իոնների տեսքով, օքսիդների կամ հիդրօքսիդների տեսքով: Քանի որ լուծույթում հավասարակշռության հաստատումը կախված է ոչ միայն ջրածնի իոններից, այլև այլ իոններից, շրջանների սահմանազատումը ձևավորվում է մի քանի հավասարակշռության գծերով: Այս տողերից յուրաքանչյուրը համապատասխանում է համապատասխան իոնների որոշակի ակտիվությանը: Դիագրամի ներքևի հատվածում ալյումինե մետաղը թերմոդինամիկորեն կայուն է և չի կոռոզիայից: Հորիզոնական գծի վերևում գտնվող ձախ մասում ալյումինի վիճակը Al3+ իոնների տեսքով լուծույթում թերմոդինամիկորեն կայուն է։ Միջին շրջանը համապատասխանում է Al2O3 օքսիդի կամ Al(OH)3 հիդրօքսիդի պինդ փուլերի կայունությանը, որոնք կոռոզիայի ընթացքում պաշտպանիչ թաղանթ են կազմում ալյումինե մակերեսի վրա։ Աջ կողմը բնութագրում է այն պայմանները, որոնց դեպքում ալյումինը կոռոզիայի է ենթարկվում լուծույթում AlO2– անիոնի ձևավորմամբ: 3.3. Էլեկտրաքիմիական կոռոզիայի մեխանիզմը Մետաղների կոռոզիան էլեկտրոլիտներում առաջանում է գալվանական զույգերի առաջացմամբ, որոնք կոչվում են կոռոզիոն զույգեր։ Եթե ցինկի և երկաթի թիթեղները, համապատասխանաբար, իջեցնեք ցինկի և երկաթի քլորիդների լուծույթներով տարայի մեջ (նման pH me գծապատկերի նկար 8-ում) և միացնեք դրանք արտաքին հաղորդիչով, ապա շղթային միացված միլիամետրը ցույց կտա. էլեկտրական հոսանքի առկայությունը շղթայում. Ձևավորվում է գալվանական զույգ, որի մեջ ցինկը կօքսիդանա և կմտնի լուծույթ (անոդ): Երկաթը չի օքսիդանա և լուծույթի մեջ չի մտնի, քանի որ ցինկի հետ զուգակցվելով՝ այն գործում է որպես կաթոդ։ Երկաթը, չհամակցված ցինկի հետ, կոռոզիայից է ենթարկվում նմանատիպ լուծույթով: Գործնականում համաձուլվածքները պարունակում են մեծ քանակությամբ միկրոտարրեր և տարբերվող մետաղներ։ Այլ կերպ ասած, աննման մետաղները գտնվում են նույն հարթության մեջ՝ միմյանց և էլեկտրոլիտի հետ անմիջական շփման մեջ։ Արդյունքը բազմաէլեկտրոդային բջիջ է, որտեղ անոդները փոխարինվում են կաթոդներով: Անոդային տեղամասերում մետաղի իոնները (Տղամարդիկ+) մտնում են լուծույթ: Ազատված էլեկտրոնները (nē) մետաղի միջով շարժվում են անոդից դեպի կաթոդ։ Մետաղների իոնների տարրալուծումը ջրային լուծույթներում պետք է ներկայացվի որպես բևեռային ջրի մոլեկուլների հետ մետաղի արտաքին մակերևույթի վրա տեղակայված իոնների՝ ատոմների փոխազդեցության արդյունք: Լուծված մետաղի իոնների փոխազդեցությունը ջրի դիպոլների հետ պայմանավորված է էլեկտրաստատիկ ձգողականության ուժերով։ Արդյունքում յուրաքանչյուր իոնի շուրջ մեծ կամ փոքր չափով (կախված նրա լիցքի մեծությունից) ձևավորվում է ջրային դիպոլների պատյան (հիդրացիայի ֆենոմեն)։ Հիդրացիայի շնորհիվ իոնի արդյունավետ շառավիղը մեծանում է, ինչի արդյունքում հիդրատացված իոնների շարժունակությունը զգալիորեն նվազում է։ Խոնավացման գործընթացն ուղեկցվում է էներգիայի արտազատմամբ, մինչդեռ ջրազրկման գործընթացը էներգիա է պահանջում։ Բացի ջրային դիպոլներից, իոնը կարող է ծածկվել այլ դիպոլների պատյանով։ Ավելի ընդհանուր առմամբ այս երեւույթը կոչվում է լուծում15: Այսպիսով, էլեկտրաքիմիական կոռոզիան բաղկացած է հետևյալ փուլերից, որոնք տեղի են ունենում զուգահեռ. - անոդային պրոցես, որը բաղկացած է մետաղի իոնների մակերևույթից լուծույթի անցումից և դրանց խոնավացումից. նյութ, լուծույթի արտադրյալը ՍՈԼՎԱՏ է։ Եթե լուծիչը ջուրն է, ապա ՀԻԴՐԱՑՈՒՄ, խոնավացման արդյունքը ՀԻԴՐԱՏ է: 15 47 Meº − nē Տղամարդիկ+ + mH2O Տղամարդիկ+ mH2O: հիդրատը կաթոդիկ պրոցես է, որը բաղկացած է էլեկտրոնների յուրացումից (գրավումից) ինչ-որ ապաբևեռացնողի կողմից (D): D + nē . Քանի որ անոդային և կաթոդիկ գործընթացները անկախ են և ավելի հեշտ են տեղի ունենում. անոդը մակերեսի ավելի բացասական սկզբնական պոտենցիալ ունեցող տարածքներում, իսկ կաթոդիկը՝ ավելի դրական, և գործնական պայմաններում դրա համար անհրաժեշտ մետաղի մակերեսի էլեկտրաքիմիական տարասեռությունը. Նշվեց, որ այս գործընթացները հիմնականում տեղի են ունենում տեղայնացված ձևով: Էլեկտրական հոսանքի հոսքն իրականացվում է մետաղի վրա՝ էլեկտրոնների շարժման միջոցով անոդային տարածքներից դեպի կաթոդ, իսկ լուծույթում, միևնույն ժամանակ, տեղի է ունենում իոնների շարժում։ Այսպիսով, ընթացիկ ուժը կարող է և ծառայում է որպես էլեկտրաքիմիական կոռոզիայի արագության չափանիշ: Հաշվեք անոդի նյութական սպառումը, այսինքն. կոռոզիայի ենթարկված մետաղի քանակը նրա մակերեսի 1 սմ2-ից կարող է օգտագործվել Ֆարադեյի բանաձևով. մետաղ, գ/սմ2; Q-ն անոդի և կաթոդի հատվածների միջև τ, [s] ժամանակի ընթացքում հոսող էլեկտրաէներգիայի քանակն է. i – ընթացիկ խտություն, A/cm2; F – Ֆարադայի համարը; n - մետաղական վալենտություն; A-ն մետաղի ատոմային զանգվածն է։ 3.4. Էլեկտրոդային պրոցեսների բևեռացումը և դրա պատճառները Երբ կոռոզիոն տարրի էլեկտրոդները կարճ միացված են, տեղի է ունենում էլեկտրոդի պոտենցիալների զգալի փոփոխություն, բայց զույգի դիմադրությունը գործնականում չի փոխվում: Այս դեպքում նկատվում է կոռոզիոն տարրի էլեկտրաշարժիչ ուժի նվազում։ Սկզբնական պոտենցիալների փոփոխությունը, որը հանգեցնում է կոռոզիոն հոսանքի և հետևաբար կոռոզիայի արագության նվազմանը, կոչվում է ԲԵՎԵՂԱՑՈՒՄ։ Կոռոզիոն տարրի աշխատանքի ընթացքում էլեկտրոդների պոտենցիալների (16) փոփոխությունը ցույց է տալիս, որ կաթոդի պոտենցիալը դառնում է ավելի բացասական (ԿԱՏՈԴԻ ԲԵՎԵՎԱՑՈՒՄ), իսկ անոդի պոտենցիալը՝ ավելի դրական (ANODIC BOLARIZATION). K, (17) o A = A + A, (18) որտեղ K և A աշխատանքային տարրի էլեկտրոդների պոտենցիալ արժեքներն են. Кº և Аo - էլեկտրոդների պոտենցիալների սկզբնական արժեքները մինչև շղթայի փակումը; K և A – կաթոդի և անոդի պոտենցիալ տեղաշարժ (բևեռացում): Այսպիսով, պոտենցիալ տարբերությունը E = K − A նվազում է: ԲԵՎԵՂԱՑՈՒՄԸ կարճ միացված տարրի մեջ էլեկտրոնների հոսքից էլեկտրոդների պրոցեսների հետաձգման հետևանք է: Օհմական դիմադրությունները (R) քիչ ազդեցություն ունեն կոռոզիայից հոսանքը նվազեցնելու վրա, քանի որ դրանք սովորաբար փոքր են: Մեծ նշանակություն ունեն բևեռացման դիմադրությունները, որոնք կապված են կամ կաթոդում էլեկտրոնների լիցքաթափման դժվարությունների հետ (Pk), կամ մետաղական ցանցից լուծույթ (PA) դրական մետաղական իոնների անցման դժվարությունների հետ: Այս դիմադրությունները, որոնք ունեն օմիկ չափում, էլեկտրաքիմիական կոռոզիայի արագության նվազման հիմնական պատճառն են։ Ընթացիկ հզորությունը շղթայի փակման պահին Օհմի օրենքի համաձայն որոշվում է Iinit = (Кº − Аo)/R, (19) բանաձևով։ Կոռոզիայից հոսանքի սկզբնական արժեքը (Iinit) ուղիղ համեմատական է Kº և Ao սկզբնական պոտենցիալ արժեքների տարբերությանը, պայմանով, որ Kº > Ao, և հակադարձ համեմատական է դիմադրությանը: Կայուն վիճակում կոռոզիոն հոսանքը (Iworking cell) որոշվում է հավասարմամբ՝ Iworking cell = (K – A)/(R + PA + PK): Այսպիսով, ես աշխատում եմ: el−ta< Iнач. Снижению скорости электрохимической коррозии или уменьшению коррозионного тока могут способствовать: − уменьшение степени термодинамической стабильности, т. е. сближение равновесных потенциалов анодного Аº и катодного Кº процессов; − торможение катодных процессов, иначе говоря, увеличение катодной поляризуемости РК; 49 − торможение анодных процессов, то есть увеличение анодной поляризуемости РА. Поляризация является весьма желательным явлением в коррозионных процессах, так как электроды замкнуты накоротко, омическое сопротивление их невелико и, следовательно, не будь поляризационных сопротивлений, коррозия протекла бы весьма интенсивно. Всякое воздействие, уменьшающее поляризацию, увеличивает скорость коррозионных процессов. Факторы, уменьшающие поляризацию электродов коррозионного элемента, называют ДЕПОЛЯРИЗАТОРАМИ, а процессы, протекающие при этом – АНОДНОЙ И КАТОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ. 3.4.1. Анодная поляризация Анодная поляризация обычно оказывает меньшее влияние на изменение разности потенциалов элемента по сравнению с катодной поляризацией. Анодный процесс, заключающийся в ионизации металла и гидратировании ионов по уравнению: Men+ + mH2O → Men+ ∙ mH2O, может протекать беспрепятственно только при условии беспрерывного отвода образующихся ионов из прианодной зоны. Торможение анодного процесса будет иметь место и в случае отставания скорости выхода ионов металла в раствор от скорости перетекания электронов на катодные участки. В результате анодной поляризации отрицательный заряд на металлической обкладке двойного слоя уменьшается, а следовательно, потенциал металла сдвинется в положительную сторону (или станет менее отрицательны). Таким образом, анодная поляризация происходит или в связи с тем, что скорость анодного процесса не поспевает за скоростью отвода электронов (перенапряжение ионизации металла), или потому, что из−за недостаточно быстрого отвода перешедших в раствор ионов металла повышается концентрация этих ионов в прианодной зоне (концентрационная поляризация). Чем легче протекает анодный процесс, тем меньше его поляризуемость. Следить за тем, легко ли протекает анодный процесс или он заметно тормозится, можно по ходу поляризационной анодной кри50 Потенциал, В вой. Эта кривая показывает зависимость потенциала электрода от плотности анодного тока на нем. Такая кривая показана на рис. 10. Удаление продуктов анодной реакции вызывает деполяризацию анода. Деполяризация анода может быть ускорена перемешиЕ Е ванием раствора, образованием о А таких продуктов коррозии, которые выпадают в осадок, а также путем образования комплексных соединений. Вследствие связывания в комплекс ионов металла, перешедших в раствор, концентрация их в прианодной зоне уменьшаПлотность тока, мА/см2 ется; анодная поляризация сниРис. 10. Анодная поляризаци- жается и переход ионов в расонная кривая твор, т.е. коррозия, усиливается. Например, медь и ее сплавы образуют в растворе аммиака хорошо растворимый комплексный ион 2+. Этим объясняется сильная коррозия меди и ее сплавов в аммиачных растворах. Поляризация анодного процесса в обычных условиях происходит в незначительной степени. Исключение представляет случай возникновения анодной пассивности. 3.4.2. Катодная поляризация Протекание катодной реакции могут тормозить два основных процесса: − торможение за счет трудности протекания самой реакции присоединения электрона деполяризатором, т. е. задержка в реакции nē + D (Dnē). Затруднение протекания катодного процесса по этой причине называется ПЕРЕНАПРЯЖЕНИЕМ РЕАКЦИИ КАТОДНОЙ ДЕПОЛЯРИЗАЦИИ; − торможение в процессе подвода к катодной поверхности деполяризатора (D) или отвода от катодной поверхности продуктов восстановления деполяризатора (Dnē). Затруднение катодного процесса по этой причине называется КОНЦЕНТРАЦИОННОЙ ПОЛЯРИЗАЦИЕЙ КАТОДА. 51 Всякий процесс захвата электрона на катоде, т.е. всякий процесс восстановления какого−либо вещества может являться катодной деполяризующей реакцией. Деполяризация катода может протекать различными путями: − ассимиляция электронов ионами: 2H+ +2ē H2, Fe3+ + ē Fe2+, Cu2+ + ē Cu+, S2O8– + ē 2SO42–; − ассимиляция электронов нейтральными молекулами: О2 + 4ē + 2Н2О 4ОН–, Cl2 + 2ē 2Cl–, Н2О2 + 2ē 2ОН–; − ассимиляция электронов нерастворимыми пленками Fe3O4 + 2ē + H2O 3FeO + 2OH–, Fe(OH)3 + ē Fe(OH)2 + OH–; − ассимиляция электронов органическими соединениями RO + 2ē + 4H+ RH2 + H2O, R + 2ē + 2H+ RH2, где R – радикал или органическая молекула. Наиболее часто встречаемыми и наиболее важными катодными деполяризационными процессами являются два: а) разряд и выделение водорода (деполяризатор ион водорода) 2H+ +2ē H2. В этом случае коррозионный процесс называется коррозией с ВОДОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ. Этому виду коррозии подвержены электроотрицательные металлы в кислотах и весьма электроотрицательные металлы, например Mg, в воде и нейтральных растворах электролитов; б) восстановление атомов или молекул кислорода электронами, притекающими на катодных участках − КИСЛОРОДНАЯ ДЕПОЛЯРИЗАЦИЯ: О2 + Н2О + 4ē 4ОН–. Деполяризатором здесь является растворенный в электролите кислород. Этот вид коррозии является наиболее распространенным. Так корродирует большинство металлов в атмосфере, почве, нейтральных растворах электролитов. Иногда оба деполяризующие процесса протекают параллельно, как например, при коррозии железа в разбавленных растворах серной кислоты в присутствии кислорода воздуха. 52 3.4.3. Водородная деполяризация Протекание коррозии металла с водородной деполяризацией возможно, если (Me)обр < (н2)обр. (20) Согласно уравнению Нернста (н2)обр = (н2)ºобр + (RT2,3/F)lg(aH+/pH21/2), (21) о где (н2) обр – стандартный обратимый потенциал водородного электрода при всех температурах (при ан+ = 1 и рН2 = 1 ат); R – универсальная газовая постоянная. Ниже приведены значения обратимого потенциала водородного электрода (н2)обр при 25 оС и различных значениях рН среды и pН2. рн2, ат 5∙10 1 –7 0 + 0,186 0 рН среды 7 − 0,228 − 0,414 14 − 0,641 − 0,828 Изменение потенциала катода при катодной деполяризации выделением водорода подчиняется ближе всего логарифмической зависимости от плотности тока. Эта зависимость определяется выражением: К = Кº – (а + b lg i). (22) Для очень малых плотностей катодного тока (меньше 10–4 – 10–5 А/см2) потенциал от плотности тока имеет линейную зависимость. Поэтому при i = 0 К = Кº, а не бесконечности, как это следует из уравнения. Поляризуемость катода при выделении на нем водорода принято определять ВЕЛИЧИНОЙ ПЕРЕНАПРЯЖЕНИЯ ВОДОРОДА на данном материале катода. Под ПЕРЕНАПРЯЖЕНИЕМ ВОДОРОДА понимают сдвиг потенциала катода при данной плотности тока в отрицательную сторону по сравнению с потенциалом водорода в том же растворе (без наложения тока) и обозначают через η η = − (К − Кº) (23) или η = a + blgI, (24) где b – константа, не зависящая от материала, рассчитывается как 2,3 ∙ 2RT / nF; а − константа, зависит от природы и состояния поверхности материала катода и численно равна величине перенапряжения при плотности тока, равной единице. 53 Поляризационная кривая для случая водородной деполяризации имеет вид кривой Кº MN (рис. 11). − N 1 M η Рис. 11. Катодная поляризационная кривая для процесса водородной деполяризации ко или (н2)обр i1 0 i P Если по оси абсцисс взять не плотность тока, а логарифм этой величины, то кривая перенапряжения будет прямой. В этом случае константа b является тангенсом угла наклона полученной прямой к оси абсцисс, константа а равна величине ординаты lg i = 0 (т.е. при плотности тока i = 1). Величина перенапряжения водорода зависит от плотности тока, т.е. при данной силе тока, от истинных размеров поверхности катода. При одинаковой силе тока она больше на гладкой поверхности, чем на шероховатой. 3.4.4. Кислородная деполяризация Процессы коррозии с КИСЛОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ могут протекать в том случае, если при данных условиях обратимый потенциал металла отрицательнее обратимого потенциала кислородного электрода (Me)обр < (О2)обр. (25) 54 Обратимый потенциал кислородного электрода может быть вычислен по уравнению Нернста: (О2)обр = (О2)ºобр + (RT2,3/4F)lg(pО2/a4ОH−) (26) где (О2)ºобр – стандартный обратимый потенциал кислородного электрода (при аOH– = 1 и рО2 = 1 ат); рО2 – парциальное давление кислорода; аОН– – активность гидроксильных ионов. Величина обратимого потенциала кислородного электрода (О2)ºобр при 25 oC для различных значений рН и рО2: рН среды ро2 , ат 0,21 1 0 + 1,218 + 1,229 7 + 0,805 + 0,815 14 + 0,391 + 0,400 Коррозия с кислородной деполяризацией является термодинамически более возможным процессом, чем коррозия с водородной деполяризацией, так как равновесный потенциал восстановления кислорода более положителен, чем равновесный потенциал выделения водорода. Коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом. Коррозии с кислородной деполяризацией подвергаются металлическая обшивка нефтезаводской аппаратуры и оборудования, детали аппаратов, соприкасающиеся с водой и нейтральными водными растворами солей (например, трубы конденсационно−холодильного оборудования), подземные трубопроводы, днища резервуаров и др. При коррозии металлов с кислородной деполяризацией катодный процесс определяется перенапряжением катодной реакции и скоростью подвода кислорода к электроду. Замедленность катодной реакции по схеме: О2 + 2Н2О + 4е 4ОН– (в щелочных или нейтральных растворах), или по схеме: О2 + 4Н+ + 4е 2Н2О (в слабо−кислых растворах) называется ПЕРЕНАПРЯЖЕНИЕМ ИОНИЗАЦИИ КИСЛОРОДА. При больших плотностях тока (при iк > 10–2 Ա/մ2) և կաթոդին թթվածնի մատակարարման զգալի արագություն, թթվածնի իոնացման գերլարումը լոգարիթմական կախվածություն ունի հոսանքի խտությունից 55 δ" = а"+ b" log i, (27) որտեղ δ" է. թթվածնի իոնացման գերլարում; a"-ը հաստատուն է, որը կախված է կաթոդի նյութից և դրա մակերեսի վիճակից, ջերմաստիճանից և այլ գործոններից: Այն թվայինորեն սահմանվում է որպես գերլարման արժեք i = 1-ում; b" հաստատուն է, որը կախված չէ կաթոդի նյութից. այն որոշվում է b" = 2RT/nF ∙ 2.3 հավասարությունից; 20° ջերմաստիճանում և n = 1, b" = 0.117: Թթվածնի կաթոդային կրճատման մեխանիզմը բավականին բարդ է և տեղի է ունենում մի քանի փուլով՝ թթվածնի տարրալուծում էլեկտրոլիտում, լուծված թթվածնի փոխանցում մետաղի կաթոդային հատվածներին, թթվածնի իոնացում։ Ի տարբերություն ջրածնի ապաբևեռացման, որի համար կոնցենտրացիայի բևեռացումը գործնականում աննշան է, թթվածնային ապաբևեռացումով մետաղների կոռոզիայի մեջ այն շատ կարևոր դեր է խաղում կաթոդին թթվածնի մատակարարման սահմանափակ արագության պատճառով: Դա բացատրվում է էլեկտրոլիտի լուծույթում թթվածնի ցածր լուծելիությամբ և, հետևաբար, դրա ցածր խտությամբ, կաթոդին հարող հեղուկի անշարժ շերտով թթվածնի տարածման դժվարությամբ։ Լուծույթի ուժեղ խառնման, ինտենսիվ շրջանառության կամ էլեկտրոլիտի զգալի օդափոխություն ապահովող պայմաններում կոռոզիայի պրոցեսն արգելակվում է թթվածնի իոնացման գերլարման պատճառով: Դիֆուզիոն պրոցեսները ազդում են կոռոզիայի արագության վրա, երբ մետաղը ընկղմվում է հանգիստ կամ թեթևակի խառնված լուծույթի մեջ: Ընդհանուր կաթոդիկ բևեռացման կորը ունի բարդ ձև (նկ. 12) և իրենից ներկայացնում է երեք կորերի ընդհանուր գումար, որոնք բնութագրում են բևեռացումը թթվածնի իոնացման (AB), կոնցենտրացիայի բևեռացման (DE) և ջրածնի իոնների արտանետման ժամանակ (GFH): Առաջին բաժնում կաթոդիկ գործընթացի արագությունը, այսինքն. մեկ միավոր ժամանակում կրճատված թթվածնի քանակը պակաս է դիֆուզիոն միջոցով թթվածնի մակերևույթ մատակարարման առավելագույն հնարավոր արագությունից: Այս առումով, այս ոլորտում գործընթացի արագությունը սահմանափակվում է հիմնականում թթվածնի կրճատման գործընթացի դանդաղությամբ: 56 − H F K E G (H2)arr 0 (O2)arr A D B C iд i Նկ. 12 Կաթոդի բևեռացման կորը թթվածնի ապաբևեռացման գործընթացի համար Ընթացիկ խտության հետագա աճի դեպքում պոտենցիալը սկզբում աստիճանաբար փոխվում է բացասական ուղղությամբ, իսկ հետո կտրուկ (CDE բաժին): Բացասական ուղղությամբ ներուժի կտրուկ տեղաշարժը կապված է թթվածնի կոնցենտրացիայի նվազման պատճառով համակենտրոնացման բևեռացման հետ: Որոշակի պոտենցիալ արժեքի դեպքում հնարավոր է դառնում նոր կաթոդիկ գործընթաց, որը սովորաբար կապված է ջրածնի ապաբևեռացման հետ (Բաժին EK): 3.5. Կոռոզիայի գործոնի վերահսկում Մետաղների և համաձուլվածքների էլեկտրաքիմիական կոռոզիայի գործընթացը բաղկացած է տարրական գործընթացներից կամ փուլերից: Կոռոզիայի գործընթացի իրական արագությունը ուղղակիորեն կախված է յուրաքանչյուր փուլում դրա ամբողջական արգելակումից: Ընդհանուր պրոցեսի արգելակման տոկոսը դրա յուրաքանչյուր փուլում բնութագրում է գործընթացի վերահսկման աստիճանը տվյալ փուլում: 57-ը կոչվում է այն փուլը, որը որոշում է կոռոզիայի մակարդակը, քանի որ այն ունի ամենամեծ դիմադրությունը մյուս փուլերի համեմատ: ՎԵՐԱՀՍԿՈՂՈՒԹՅԱՆ ԳՈՐԾԸՆԹԱՑ o2)arr imax I imax b b b a (o2)arr A A imax (Me)arr (Me)arr K ∆K K ∆K K I I S (о2)arr i I g g d d Նկ. 13. Էլեկտրաքիմիական կոռոզիոն պրոցեսների մոնիտորինգի հիմնական գործնական դեպքերի բևեռացման կոռոզիայի դիագրամներ 58 I in Գործնական պայմաններում կան մետաղների և համաձուլվածքների էլեկտրաքիմիական կոռոզիայի մոնիտորինգի մի քանի հիմնական դեպքեր՝ հիմնավորված Ն.Դ. Տոմաշով. Bekkerev I.V. «Մետաղներ և համաձուլվածքներ - Դասակարգեր, քիմիական բաղադրություն», Մաս 2, Ուլյանովսկ: Ուլյանովսկի պետական տեխնիկական համալսարան, 2007 թ. 630, http://www.bibliotekar.ru/spravochnik-73/index.htm. 3]. Սեմենովա Ի.Վ. Կոռոզիայից և կոռոզիայից պաշտպանություն, M.: Fizmatlit, 2002, 335 p. 4]. Խալդեև Գ.Վ., Բորիսովա Թ.Ֆ. «Մետաղների և համաձուլվածքների ջրածնային թափանցելիությունը կոռոզիոն-էլեկտրաքիմիական գործընթացներում. Էլեկտրաքիմիա» - հատոր 30, Մոսկվա, 1989 թ. 232 5]: T. L. Lukanina, T. T. Ovchinnikova, V. Ya Sigaev, «Ընդհանուր քիմիա» Մաս II. Ուսուցողական. 2-րդ հրատարակություն, ճշգրտված և ընդլայնված, 2006 թ.)